
某混合溶液中所含离子及其浓度如表所示(忽略溶液中的OH﹣),则M可能为( )
| 离子 | NO3﹣ | SO42﹣ | H+ | M |
| 浓度/mol•L﹣1 | 2 | 1 | 2 | 1 |
|
| A. | Cl﹣ | B. | Ba2+ | C. | NO3﹣ | D. | Mg2+ |
| 物质的量浓度的相关计算. | |
| 专题: | 守恒法. |
| 分析: | 根据电解质混合溶液中阴阳离子所带电荷相等确定M离子所带电荷,并利用离子之间的反应来判断存在的离子. |
| 解答: | 解:溶液中,单位体积内已知的阳离子所带电量为:2mol/L×1=2mol/L, 单位体积内已知的阴离子所带总电量为:2mol/L×1+1mol/L×2=4mol/L, 阴离子所带电荷多,故M为阳离子, 设M离子的电荷为x,由电荷守恒可知:4=2+x×1,解得x=+2, 结合选项可知,M为Ba2+或Mg2+,又SO42﹣与Ba2+能结合生成硫酸钡沉淀,不能共存,则溶液中存在的离子为Mg2+, 故选D. |
| 点评: | 本题考查物质的量浓度的有关计算、离子共存,难度不大,利用电荷守恒确定M所带电荷是关键. |


科目:高中化学 来源: 题型:
下列物质的溶液加热蒸发至干、灼烧,所得固体的成分不相同的是
( )
A.FeCl2、FeCl3 B.FeCl2、Fe2(SO4)3
C.Na[Al(OH)4]、AlCl3 D.Mg(HCO3)2、MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
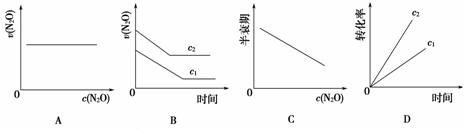
在一定条件下,N2O分解的部分实验数据如下:
| 反应时 间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| c(N2O)/ (mol·L-1) | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
下图能正确表示该反应有关物理量变化规律的是( )
(注:图中半衰期指任一浓度N2O消耗一半时所需的相应时间,c1、c2均表示N2O初始浓度且c1<c2)
查看答案和解析>>
科目:高中化学 来源: 题型:
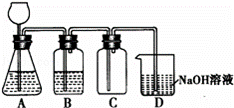
某化学兴趣小组利用Mn02和浓HCl及如图所示装置制备Cl2.下列分析中不正确的是( )
|
| A. | A中可用分液漏斗代替长颈漏斗 |
|
| B. | A中缺少加热装置 |
|
| C. | B中盛放的NaOH溶液可以净化Cl2 |
|
| D. | D中的导管口若连接倒置漏斗可防止倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
若以ω1和ω2分别表示浓度为amol•L﹣1和bmol•L﹣1氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小)( )
|
| A. | 2ω1=ω2 | B. | 2ω2=ω1 | C. | ω2>2ω1 | D. | ω1<ω2<2ω1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据反应:2H2S+O2=2H2O+S、4NaI+O2+2H2SO4=2Na2SO4+2I2+2H2O、Na2S+I2=2NaI+S,下列物质氧化性强弱的判断正确的是( )
|
| A. | O2>I2>S | B. | H2S>NaI>H2O | C. | S>I2>O2 | D. | H2O>NaI>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为________,氧化性最弱的简单阳离子是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com