
分解水制氢气的工业制法之一是硫——碘循环,主要涉及下列反应:
I SO2+2H2O+I2→H2SO4+2HI
II 2HI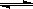 H2+I2
H2+I2
III 2H2SO4 → 2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是_________
a.反应III易在常温下进行 b.反应I中SO2还原性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2的同时产生1molH2
(2)一定温度下,向2L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。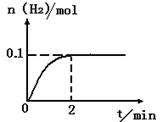
0—2min内的平均反应速率v(HI)= _________ 。该温度下,反应2HI(g)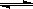 H2(g)+I2(g)的平衡常数表达式为K=_______________________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_________是原来的2倍。
H2(g)+I2(g)的平衡常数表达式为K=_______________________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_________是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
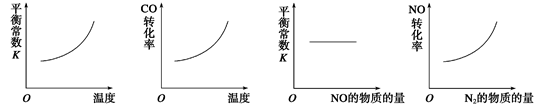
(3)SO2在一定条件下可氧化生成SO3,其主反应为:2SO2 (g) + O2(g)  2SO3(g) + Q,若此反应起始的物质的量相同,则下列关系图正确的是_________ (填序号)
2SO3(g) + Q,若此反应起始的物质的量相同,则下列关系图正确的是_________ (填序号)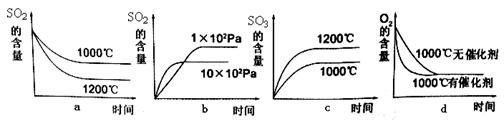
实际工业生产使用的条件是:常压、____________________________________选择该条件的原因是__________________。
(4)实际生产用氨水吸收SO2生成亚硫酸的铵盐。现取a克该铵盐,若将其中的SO2全部反应出来,应加入18.4 mol/L的硫酸溶液的体积范围为______________。
(1)bc(2分)
(2)0.05mol·L-1·min-1;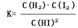 ;b (各1分)
;b (各1分)
(3)bd;五氧化二钒、500℃;加快反应速度。(共5分)
(4)a/116×18.4~a/198×18.4 (2分)
解析试题分析:(1)a.反应III2H2SO4 → 2SO2+O2+2H2O是分解反应,要在高温下进行。b.根据还原剂的还原性强于还原产物的还原性,故反应I中SO2还原性比HI强,正确。c.水在循环过程中始终消耗,故需补充H2O,正确。d.根据电子守恒,循环过程中产生1molO2转移4mol电子,同时产生2molH2,错误。故选bc。
(2)根据平均反应速率v(HI)="2v(H2)=2*0.1/(2*2" )= 0.05mol·L-1·min-。该温度下,反应2HI(g)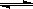 H2(g)+I2(g)的平衡常数表达式为K=
H2(g)+I2(g)的平衡常数表达式为K=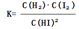 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,根据反应前后体积不变这个特点可知与原平衡是等效平衡,则HI的平衡浓度是原来的2倍,而平衡常数只与温度有关,温度不变,平衡常数也不变,平衡时H2的体积分数相同。
。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,根据反应前后体积不变这个特点可知与原平衡是等效平衡,则HI的平衡浓度是原来的2倍,而平衡常数只与温度有关,温度不变,平衡常数也不变,平衡时H2的体积分数相同。
(3)根据反应2SO2 (g) + O2(g)  2SO3(g) + Q的特点,正反应体积减小,放热反应,故关系图正确的是bd。实际工业生产还要根据设备的成本,反应速率及催化剂的适宜温度综合考虑故使用的条件是:常压、五氧化二钒、500℃;选择该条件的原因是加快反应速度。
2SO3(g) + Q的特点,正反应体积减小,放热反应,故关系图正确的是bd。实际工业生产还要根据设备的成本,反应速率及催化剂的适宜温度综合考虑故使用的条件是:常压、五氧化二钒、500℃;选择该条件的原因是加快反应速度。
(4)亚硫酸的铵盐正盐和酸式盐两种情况。若a克分别是两种铵盐时,应加入18.4 mol/L的硫酸溶液的体积设为v,则
(NH4)2SO3 -----H2SO4 2NH4HSO3----H2SO4
a/116 a/116 a/99 a/198
v=a/116×18.4 v=a/198×18.4,应加入18.4 mol/L的硫酸溶液的体积范围为a/198×18.4----a/116×18.4。
考点:本题考查化学平衡状态,化学平衡常数,反应速率计算,用极值法解决化学计算。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:填空题
如图表示某温度时,反应N2O4(g) 2NO2(g)在前110 s内的反应进行情况,请根据图像回答下列问题。
2NO2(g)在前110 s内的反应进行情况,请根据图像回答下列问题。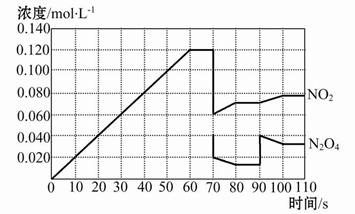
(1)该可逆反应达到平衡的时间段为 。
(2)反应进行到70 s时,改变的条件可能是 (填字母,下同),反应进行到90 s时,改变的条件可能是 。
| A.加入催化剂 | B.扩大容器体积 |
| C.升高温度 | D.增大N2O4的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
向2.0L恒容密闭容器中充人1.0mol PCl5,在温度为T时发生如下反应
PCl5(g)  PCl3(g)+C12(g)
PCl3(g)+C12(g)  H=124kJ·mol-1。反应过程中测定的部分数据见下表:
H=124kJ·mol-1。反应过程中测定的部分数据见下表:
| 时间t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCL3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮氧化物是空气的主要污染物,消除氮氧化物污染有多种方法。用催化技术可将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO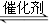 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
| 时间(s) | 0 | 2 | 4 |
| c(NO) ( mol·L-1) | 1.00×10-3 | 2.50×10-4 | 1.00×10-4 |
| c(CO) ( mol·L-1) | 3.60×10-3 | c’ | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
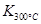 >
>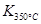 ,则该反应是 热反应。
,则该反应是 热反应。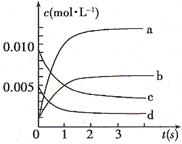
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应:
TaS2(s)+2I2(g) TaI4(g)+S2(g) (Ⅰ)
TaI4(g)+S2(g) (Ⅰ)
某温度反应(Ⅰ)的K=4,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为 。
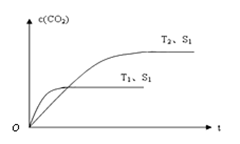
(2)如下图所示,反应(Ⅰ)在石英真空管中进行,先在温度高(T2)的一端放入未提纯的TaS2粉末和少量I2(g),加热一段时间后,在另一端温度低(T1)的一端得到了纯净的TaS2晶体,则该正反应的△H 0(填“>”或“<”),上述反应体系中循环使用的物质是 。
(3)上图为钠硫高能电池的结构示意图。该电池的工作温度为320℃左右,电池反应为2Na + xS=Na2Sx,正极的电极反应式为____________________________。M(由Na2O和Al2O3制得)的两个作用是________________________________________________和隔离钠与硫。
(4)写出Na2S溶液水解的离子方程式_______________________________________,Na2S溶液中c(H+)+ c(Na+)=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
t℃时,将3 mol A和1 mol B气体通人体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
xC(g),2min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol/L,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为 ;
(2)x= ;
(3)若向原平衡混合物的容器中再充人a mol C,在t℃时达到新的平衡,此时B的物质的量为n(B)= mol;
(4)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.在体积恒定的密闭容器中,充入2mol CO2和5mol H2,一定条件下发生反应: CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) △H =" -49.0" kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示:
CH3OH(g) + H2O(g) △H =" -49.0" kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示: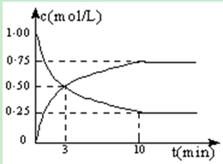
(1)从反应开始到第10min,H2的转化率为 ,在 该条件下,反应的平衡常数K= ,如果在某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡 (选填序号)。
a.向正向移动 b.向逆向移动
c.不移动 d.无法确定平衡移动方向
(2)下列措施中能使n(CH3OH)/n(CO2)增大的是 (选填序号)。
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离 d.再充入l mol CH3OH(g)
II.熔融碳酸盐燃料电池(MCFS),发明于1889年。现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示。请回答下列问题:
(1)A电极的电极反应方程式为 。
(2)常温下,用石墨作电极,以此电源电解一定量的CuSO4 溶液。当两极产生的气体体积相同时停止通电,若电解后溶液的体积为2L,溶液的pH=1(不考虑水解产生的H+),则阳极产生的气体的物质的量是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有反应:mA(g)+ B(g) 2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
(1)该反应的△H 0(填“>”或“<”),且m 1(填“>”“=”“<”)。
(2)若加入B(假设容器的体积不变),则A的转化率 ,B的转化率 。 (填“增大”“减小”或“不变”)
(3)若B是有色物质,A、C均无色,则加入C(假设容器的体积不变)时混合物颜色 ,而维持容器内压强不变,充入氖气时,混合物颜色 (填“变深”“变浅”或“不变”)。
(4)一定温度下,向1L密闭容器中加入1mol C(g)使其分解,气体A的物质的量随时间的变化如下图所示。则0~2 min内的平均反应速率υ(C)= 。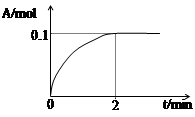
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com