
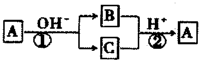
| A. | 反应①和②是可逆反应 | B. | 反应①和②一定为氧化还原反应 | ||
| C. | X元素可能是金属,也可能是非金属 | D. | X元素为铝 |
分析 由转化关系图可以看出,A这种单质与强碱发生反应,生成了两种产物B和C,而且B和C均含有同一种元素,且B和C又可以在强酸的作用下发生反应,生成单质A,那么可以看出反应1应该是A物质的歧化反应,反应2应该是关于一种元素的归中反应,则可以知道B和C中应该分别含有A的负价态物质以及正价态物质,则A可能为Cl2或S,应为非金属元素.
解答 解:A单质与强碱发生反应,生成了两种产物B和C,而且B和C均含有同一种元素,且B和C又可以在强酸的作用下发生反应,生成单质A,可以看出反应①是A物质的歧化反应,反应②应该是这种元素的归中反应,所以B和C中应该分别含有A的负价态物质以及正价态物质,元素有负价只能是非金属,因为金属元素无负价,说明X元素是非金属元素,判断A一定是非金属元素;
A.可逆反应的定义是指在同一条件下,既能向正反应方向进行,同时又能向逆反应的方向进行的反应,叫做可逆反应,上述①②两个反应的反应条件不相同,不是可逆反应,故A错误;
B.单质A生成化合物,元素的化合价发生变化,化合物生成A单质,化合价了发生变化,所以反应①和反应②一定属于氧化还原反应,故B正确;
C.①应该是A物质的歧化反应,反应②应该是一种元素的归中反应,则可以知道B和C中应该分别含有A的负价态物质以及正价态物质,元素有负价只能是非金属,因为金属元素无负价,说明X元素是非金属元素,可以判断A不可能是金属,如A为Cl2,在碱性条件下反应生成Cl-和ClO-,二者在酸性条件下可生成Cl2,符合框图转化关系,故C错误;
D.A单质在碱性条件下发生反应生成B和C两种化合物,发生了氧化还原反应,化合价既升高又降低,存在负化合价,应为非金属元素,金属元素不存在负价,故D错误;
故选B.
点评 本题考查了元素化合物的性质推断,主要考查非金属元素的歧化反应和归中反应的特征应用,关键是理解金属无负价,题目难度中等.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | B. | H2+Cl2═2HCl | ||
| C. | 2Na2O2+2CO2═2Na2CO3+O2 | D. | Fe+CuSO4═FeSO4+Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I-,AlO2-,Cl-,S2- | B. | Na+,K+,NH4+,Ba2+ | ||
| C. | Br-,HS-,Cl-,CO32- | D. | SO32-,NO3-,SO42-,HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①④⑤ | C. | ④⑥⑦ | D. | ①④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池负极金属一定比正极金属的金属性活泼 | |
| B. | 原电池中电解质溶液中的阳离子向负极移动 | |
| C. | 碱性锌猛锰干电池的负极反应为:Zn-2e-+4OH-=ZnO22-+2H2O | |
| D. | 铅蓄电池工作时转移电子数为2NA时,负极材料质量减少207g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 再通入$\frac{W}{10}$g氯化氢 | B. | B、蒸发浓缩成$\frac{W}{2}$g | ||
| C. | 蒸发掉溶剂的一半 | D. | 再加入2Wg25%盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com