
| A. | H2O2 | B. | CO2 | C. | Na2O2 | D. | F2 |
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 解释或结论 |
| A | 向某溶液中加入NaOH并微热,产生能使湿润的红色石蕊试纸变蓝的气体 | 原溶液中一定存在NH4+ |
| B | 铜粉不能溶于冷的浓硫酸 | 铜在冷的浓硫酸中发生钝化 |
| C | 往溴水中通入SO2,溶液褪色 | SO2具有还原性 |
| D | 向FeCl2溶液中通入Cl2,溶液由浅绿色变为黄色 | Cl2的氧化性比FeCl3的强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
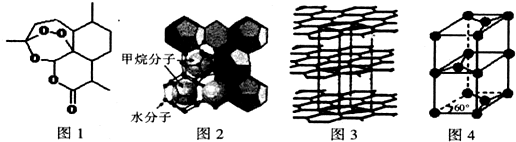
 科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.
科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种:1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36.已知X的一种:1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子.| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1539 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解、煤的气化、海水制镁等过程中都包含化学变化 | |
| B. | 在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 | |
| C. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强酸、强碱都会“断路” | |
| D. | 硬脂酸甘油酯在碱性条件下的水解属于皂化反应,乙酸乙酯在碱性条件下的水解不属于皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 甲烷的球棍模型: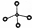 | |
| B. | 乙炔的结构简式:CH=CH | |
| C. | 3-甲基-1-丁烯的结构简式:(CH3)2CHCH=CH2 | |
| D. | 羟基的电子式: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com