
| A. | 金属与非金属元素形成的化合物一定是离子化合物 | |
| B. | 干冰气化过程中只需克服分子间作用力 | |
| C. | HF的热稳定性很好,是因为HF分子间存在氢键 | |
| D. | 常温常压下,气态单质分子中,每个原子的最外层都具有8电子稳定结构 |
科目:高中化学 来源: 题型:选择题
 ,下列关系不正确的是( )
,下列关系不正确的是( )| A. | 原子半径:K>Ga>Al | B. | 碱性:KOH>Ga(OH)3>Al(OH) 3 | ||
| C. | 离子的氧化性:K+>Ga3+>Al3+ | D. | 与水反应的剧烈程度:K>Ga>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol C4H10中含有的共价键数为6.5NA | |
| B. | 3.4 g羟基和3.4 g氢氧根均含有2NA个电子 | |
| C. | 1L0.1 mol•L-1CH3COOH溶液中含有的氧原子数为0.2NA | |
| D. | 标准状况下,22.4L由CHCl3和CH2Cl2组成的混合物中含有的分子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③④ | C. | ①②③⑤ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | m+n>p | B. | 平衡向逆反应方向移动 | ||
| C. | A的转化率减小 | D. | C的体积分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
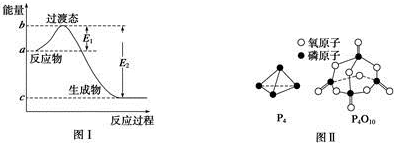
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/kJ•mol-1 | a | b | c | x |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com