
| A. | 室温下,1L0.3mol•L-1CH3COOH溶液和3L0.1 mol•L-1CH3COOH溶液中的H+数 | |
| B. | 纯水在25℃和80℃时的pH | |
| C. | 在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数 | |
| D. | 相同条件下,H2分别与Cl2、F2反应的反应速率 |
分析 A.弱电解质溶液中,溶液越稀,其的电离程度越大,根据溶质的物质的量和电离程度确定氢离子数;
B.水的电离是吸热反应,升高温度促进电离;
C.根据氧化还原反应中得失电子数相等配平方程式,再根据还原剂和氧化剂的计量数计算被氧化和被还原的N原子数之比;
D.物质的性质决定其反应速率.
解答 解:A.1L 0.3mol•L-1 CH3COOH溶液中醋酸的物质的量是0.3mol,3L 0.2mol•L-1 CH3COOH溶液中醋酸的物质的量是0.6mol,溶液越稀,醋酸的电离程度越大,所以3L 0.2mol•L-1 CH3COOH溶液中氢离子数大于1L 0.3mol•L-1 CH3COOH溶液中的H+数,故A错误;
B.水的电离是吸热反应,升高温度促进电离,所以纯水在25℃的pH大于80℃时的pH,故B正确;
C.该反应方程式为:4NH3+6NO=5N2+6H2O,该反应中氨气是还原剂被氧化,一氧化氮是得电子被还原,所以被氧化的N原子数小于被还原的N原子数,故C错误;
D.物质的性质决定其反应速率,氟气的活泼性大于氯气,相同条件下,所以氢气和氟气的反应速率大于和氯气的反应速率,故D错误;
故选B.
点评 本题考查了弱电解质的电离、氧化还原反应、反应速率等知识点,难度不大,注意物质的性质决定其反应速率,外界条件只是影响因素.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe+2 H+=Fe3++H2↑ | B. | Fe3++Cu=Cu2++Fe2+ | ||
| C. | Cu+2H+=Cu2++H2↑ | D. | 2Fe3++Fe=3Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{\;}^{13}$O和14O互称同素异形体 | B. | 丙烷和异丁烷互称同系物 | ||
| C. | 金刚石和石墨互称同位素 | D. | 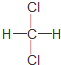 和 和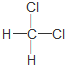 互称同分异构体 互称同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸中的c(Cl-)与醋酸溶液中的c(CH3COO-)相等 | |
| B. | 分别与足量CaCO3反应,放出的CO2一样多 | |
| C. | 分别用水稀释相同倍数,n(Cl-)<n(CH3COO-) | |
| D. | 分别将两溶液升温至80℃,醋酸溶液的pH变小,盐酸的pH不变(不考虑挥发) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
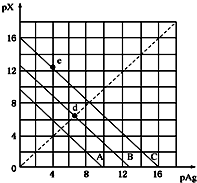 某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )
某温度时,卤化银(AgX,X=Cl,Br,I)的3条溶解平衡曲线如图所示,AgCl,AgBr,AgI的Ksp依次减小.已知pAg=-lgc(Ag+),pX=-lgc(X-),利用pX-pAg的坐标系可表示出AgX的溶度积与溶液中的c(Ag+)和c(X-)的相互关系.下列说法错误的是( )| A. | A线是AgCl的溶解平衡曲线,C线是AgI的溶解 | |
| B. | 坐标点(8,4)形成的溶液是AgCl的不饱和溶液平衡曲线 | |
| C. | d点是在水中加入足量的AgBr形成的饱和溶液 | |
| D. | e点表示由过量的KI与AgNO3反应产生AgI沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com