
已知元素X的电负性数值为2.5,元素Y的电负性数值是3.5,元素Z的电负性数值为1.2,元素W的电负性数值为2.4。你认为上述四种元素中,哪两种最容易形成离子化合物
A.X与Y B.X与W C.Y与Z D.Y与W
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
分别向1 L 0.5 mol·L-1的BaOH)2溶液中加入①浓硫酸、②稀硫酸、③稀硝酸,恰好完全反应时的热效应分别为ΔH1、ΔH2、ΔH3,下列关系中正确的是 )。
A.ΔH1>ΔH2>ΔH3 B.ΔH1<ΔH2<ΔH3
C.ΔH1>ΔH2=ΔH3 D.ΔH1=ΔH2<ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物A(C4H6O5)广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内最多,是一种常用的食品添加剂。该化合物具有如下性质:
(ⅰ)在25 ℃时,电离平衡常数K1=3.9×10-4,K2=5.5×10-6
(ⅱ)A+RCOOH(或ROH)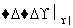 有香味的产物
有香味的产物
(ⅲ)1 mol A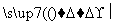 慢慢产生1.5 mol气体
慢慢产生1.5 mol气体
(ⅳ)核磁共振氢谱表明A分子中有5种不同化学环境的氢原子。
与A相关的反应框图如下:
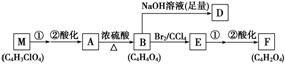
(1)根据化合物A的性质,对A的结构可作出的判断是
________________________________________________________________________(填序号)。
a.肯定有碳碳双键 b.有两个羧基
c.肯定有羟基 d.有—COOR官能团
(2)写出A、F的结构简式:
A:________________________________________________________________________;
F:________________________________________________________________________。
(3)写出下列反应类型:A—→B____________;B—→E____________。
(4)写出下列反应的反应条件:
E—→F第①步反应___________________________________________________________。
(5)在催化剂作用下,B与乙二醇可发生缩聚反应,生成的高分子化合物用于制造玻璃钢。写出该反应的化学方程式:____________________________________________________。
(6)写出与A具有相同官能团的A的同分异构体的结构简式:_________________________
_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H—H键能为436kJ·mol-1,N—H键能为391kJ·mol-1,根据化学方程式:N2+3H2 2NH3,1mol N2与足量H2反应放出的热量为92.4kJ·mol-1,那么N≡N键的键能是( )
2NH3,1mol N2与足量H2反应放出的热量为92.4kJ·mol-1,那么N≡N键的键能是( )
A.431kJ·mol-1 B.945.6kJ·mol-1 C.649kJ·mol-1 D.896kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C三种短周期元素,原子序数依次增大,三种元素原子序数之和为35,A、C同主族,B+核外有10个电子,回答下列问题:
(1)B元素是______________(填元素符号)。
(2)A、B、C中任意两种元素之间可形成多种化合物,其中属于离子化合物的化学式分别为________、________、________。B和C两元素组成的化合物的水溶液显 (酸、碱、中)性。
(3)写出基态A原子的电子排布式:A________。画出基态C原子的价电子的电子排布图(轨道表示式) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组对加碘食盐中碘酸钾进行研究。
(1)学生甲设计实验测出加碘食盐中碘元素的含量,步骤如下:
a.称取W g加碘盐,加适量蒸馏水溶解;
b.用稀硫酸酸化,再加入过量KI溶液;
c.以淀粉为指示剂,用物质的量浓度为1.00×10-3 mol·L-1的Na2S2O3标准溶液滴定。
(已知:IO +5I-+6H+===3I2+3H2O,I2+2S2O
+5I-+6H+===3I2+3H2O,I2+2S2O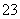 ===2I-+S4O
===2I-+S4O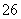 )
)
滴定时Na2S2O3溶液应放在________(填“酸式滴定管”或“碱式滴定管”),滴定至终点时消耗Na2S2O3溶液20.00 mL,其终点颜色变化为________;加碘食盐样品中的碘元素含量是____________mg·kg-1(以含W的代数式表示)。
(2)学生乙对纯净的NaCl(不含KIO3)进行了下列实验:
| 顺序 | 步骤 | 实验现象 |
| ① | 取少量纯净的NaCl, 加蒸馏水溶解 | 溶液无变化 |
| ② | 滴加淀粉KI溶液,振荡 | 溶液无变化 |
| ③ | 然后再滴加稀H2SO4溶液,振荡 | 溶液变蓝色 |
请推测实验③中产生蓝色现象的可能原因:__________;根据学生乙的实验结果,请对学生甲的实验结果作出简要评价____________________。
(3)工业上通常用电解KI溶液的方法来制备碘酸钾,电解过程中请你帮助学生丙设计实验来判断电解是否完全。仪器不限,可选的试剂:淀粉溶液、H2O2溶液、稀硫酸。
| 实验操作 | 实验现象及结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com