
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制200mL 1.0mol/L的稀硫酸.可供选用的仪器有:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制200mL 1.0mol/L的稀硫酸.可供选用的仪器有:| 1000ρω |
| M |
| n |
| V |
| 1000×1.84g/ml×98% |
| 98g/mol |


科目:高中化学 来源: 题型:
| A、C2H6、C3H6 |
| B、C3H8、C3H6 |
| C、CH4、C4H8 |
| D、C3H8、C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| A | 原子的核外电子数和电子层数相等 |
| B | 基态原子价电子排布为nsnnpn |
| C | 气态氢化物与最高价氧化物的水化物反应生成盐 |
| D | 基态原子电子排布有2个未成对电子 |
| E | 位于第三周期,在同周期中原子半径最大 |
| F | 与B 形成的合金为目前用量最多的金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
| B、氯气溶于水:Cl2+H2O?2H++Cl-+ClO- |
| C、亚硫酸氢钠溶液中滴加硫酸氢钠溶液:H++HSO3-=SO2↑+H2O |
| D、氢氧化铁溶于氢碘酸溶液:Fe(OH)3+3H+=Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
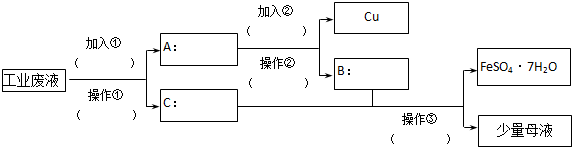
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 结果分析 |
| 步骤①:取少量样品于试管中,加入适量蒸馏水使之溶解, | 有白色沉淀生成,说明产品中含有NaC1 |
| 步骤②:另取少量样品于锥形瓶中,加入适量蒸馏水使之溶解,加入几滴酚酞,用0.1000mol?L-1盐酸滴定至溶液由红色变无色,记录消耗盐酸的体积Vl; |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由于铜盐能杀死某些细菌,并能抑制藻类生长,因此游泳池馆常用硫酸铜作池水消毒剂 |
| B、明矾溶于水后能生成Al(OH)3胶体,它能凝聚水中的悬浮物并起到杀菌消毒的作用,从而达到净水的目的 |
| C、铝制品表面有致密的氧化膜保护层,所以不能盛放酸、碱溶液,但可以长时间盛放咸菜等腌制品 |
| D、工业电解氧化铝时,向其中添加冰晶石,使氧化铝的熔点降低,从而减少冶炼过程中的能量消耗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com