
����Ŀ������������
��1��ij�����з�����һ����ѧ��Ӧ����Ӧ�����д���H2O��ClO����CN����HCO3����N2��Cl���������ӣ��ڷ�Ӧ�����в��ClO����N2�����ʵ�����ʱ��仯��������ͼ��ʾ�� 
�÷�Ӧ�����ӷ���ʽ�� ��
��2�������������Ǵ�����Ⱦ����Ҫ�����أ���NOxת��Ϊ�������ǵ�ǰ�о�����Ҫ���⣮
����ʽ��X����Ϊ����Ⱦ�����ʣ�ϵ��n����Ϊ0��
NO2+G ![]() N2+H2O+nX��δ��ƽ�ķ�Ӧʽ����
N2+H2O+nX��δ��ƽ�ķ�Ӧʽ����
���л������У�����������Ӧʽ�е�G������д��ĸ����
a��NH3 b��CO2 c��SO2 d��CH3CH2OH
����GΪ��Ȼ������Ҫ�ɷ֣���XΪ �� n= ��
���𰸡�
��1��H2O+5ClO��+2CN��=N2��+5Cl��+2HCO3��
��2��ad��CO2��1
���������⣺��1�������߱仯ͼ��֪���淴Ӧ����N2�����ʵ�������N2���������CN��Ӧ�Ƿ�Ӧ�NԪ�ػ��ϼ۷����仯�����������Ե�ClO��Ϊ��Ӧ�����Ԫ���غ��֪Cl�����������Ӧ�ķ���ʽӦΪH2O+5ClO��+2CN��=N2��+5Cl��+2HCO3�� �� ���Դ��ǣ�H2O+5ClO��+2CN��=N2��+5Cl��+2HCO3������2���ٶ���������NԪ�صĻ��ϼ���+4�۽���Ϊ0����GΪ��ԭ����G��Ԫ�صĻ��ϼۿ����ߣ�XΪ����Ⱦ�����ʣ�G�к�HԪ�أ���GΪ�������Ҵ������Դ��ǣ�ad����GΪ��Ȼ������Ҫ�ɷ֣�GΪ���飬����2NO2+CH4 ![]() N2+2H2O+CO2 �� ��֪XΪCO2 �� n=1�����Դ��ǣ�CO2��1��
N2+2H2O+CO2 �� ��֪XΪCO2 �� n=1�����Դ��ǣ�CO2��1��


 ѧ���쳵�����ּ��ں�����ҵϵ�д�
ѧ���쳵�����ּ��ں�����ҵϵ�д� ��˼ά������ҵϵ�д�
��˼ά������ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ش�����
��1�����ؾ��ǰ���ת���ܵ�װ��
��2��������KW��ֵ= ��
��3�������£�ij��Һ�е�c��H+��=5.0��10��7 molL��1 �� ���ʱc��OH����=molL��1 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ��������֪���ʵ���Ũ�ȵ��������ⶨδ֪���ʵ���Ũ�ȵ�����������Һʱ��ѡ���̪��ָʾ��������д���пհף�
��1���ñ���������Һ�ζ����������������Һʱ�����ְ�����ʽ�ζ��ܵĻ���������ҡ����ƿ���۾�ע�� �� ֱ��Ϊֹ��
��2�����в����п���ʹ��������������Һ��Ũ����ֵƫ�͵��� ��
A.��ʽ�ζ���δ�ñ�������Һ��ϴ��ֱ��ע���������Һ
B.�ζ�ǰʢ������������Һ����ƿ������ˮϴ����û�и���
C.��ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ
D.��ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���
��3�����ζ���ʼ�ͽ���ʱ����ʽ�ζ����е�Һ����ͼ1��ͼ2��ʾ���뽫�����������Ŀհ״���
�ζ����� | ��������������Һ�����/mL | 0.1000mol/L ��������/mL | ||
�ζ�ǰ�̶� | �ζ���̶� | ��Һ���/mL | ||
��һ�� | 25.00 | |||
�ڶ��� | 25.00 | 1.56 | 28.08 | 26.52 |
������ | 25.00 | 0.22 | 26.34 | 26.12 |
��4��������ϱ���������ʽ���������������Һ�����ʵ���Ũ�ȣ�c��NaOH��= �� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��֤�����ԣ�Cl2��Fe3+��SO2 �� ijС����ͼ��ʾװ�ý���ʵ�飨�г�������A�еļ���װ�����ԣ��������Ѿ�������ϣ�ʵ�������ͼ�� 
���ɼ�K1��K4 �� ͨ��һ��ʱ��N2 �� �ٽ�T�͵��ܲ���B�У�����ͨ��N2 �� Ȼ��ر�K1��K3��K4 ��
����a���μ�һ������Ũ���ᣬ��A���ȣ�
��B����Һ���ʱ��ֹͣ���ȣ��н����ɼ�K2 ��
��������b��ʹԼ2mL����Һ����D�Թ��У��������е������ӣ�
�������ɼ�K3������c������70%�����ᣬһ��ʱ���н����ɼ�K3 ��
���������Թ�D���ظ����̢�������B��Һ�е����ӣ�
��1�����̢��Ŀ���� ��
��2�����н������ҺΪ �� ������
��3��A�з�����Ӧ�Ļ�ѧ����ʽ ��
��4�����²��������Һ��Ƶ����ӷ�Ӧ�� �� ����д�Լ���ѧʽ������������������� ��
��5����˵��������Fe3+��SO2�����ӷ���ʽ�� ��
��6���ס��ҡ�����λͬѧ�ֱ����������ʵ�飬���ǵļ����һ���ܹ�֤��������Cl2��Fe3+��SO2��������ס����ҡ�����������
���̢�B��Һ�к��е����� | ���̢�B��Һ�к��е����� | |
�� | ��Fe3+��Fe2+ | ��SO42�� |
�� | ����Fe3+����Fe2+ | ��SO42�� |
�� | ��Fe3+��Fe2+ | ��Fe2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����AgNO3��Cu(NO3)2��Zn(NO3)2�����Һ�У�����һ���������ۣ���ַ�Ӧ����ˣ��������м���ϡ���ᣬ����������������н�����ȷ����
A. ��Һ��һ����Fe(NO3)3
B. ����ֻ��Ag��Cu��һ����Zn
C. ������һ����Ag��Cu��Fe��һ����Zn
D. ������һ����Ag��Cu��Fe��Zn
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С�����Ĺ�����������ͼ��ʾ����֪����һ���Σ������н�����ȷ���ǣ� �� 
A.��������S2�� �� ��������dz���
B.�������AgCl����������FeCl3
C.���п϶�����Fe3+ �� ���Լ���FeBr2
D.���к�����Ԫ�أ�������+2�ۻ�+3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������м��㣺
��1��32gͭͶ��һ��Ũ�ȵ�������Һ�У�ͭ��ȫ�ܽ⣬���ռ���NO��NO2�Ļ������8.96L���壨��״������ �ټ������NO���������״����L
�ڽ�ʢ�д˻�����������������ˮ�У�ͨ���״����һ�������O2 �� ǡ��ʹ������ȫ����ˮ�У���ͨ��O2�����ΪL��
��2����100mL 0.8mol/L������Һ�м���һ����Fe��FeO��Fe2O3�Ļ�����ַ�Ӧ�ų���״���µ�����224mL���Ҳ����Һ����ֻ��Fe2+��ʽ���ڣ�ΪʹFe2+��ȫ����������Ӧ�����Һ�м���0.1mol/L��NaOH��ҺmL��
��3��������2�������ỻΪ���ᣬ���������䣬������NaOH��Һ�����ΪmL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ���Ҵ�ȼ�ϵ�ع���ʱ��ʾ��ͼ���ҳ��е������缫һ����ʯī�缫��һ�������缫������ʱM��N�����缫�������������٣���ش��������⣺ 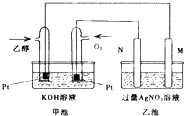
��1��M�缫�IJ����� �� �缫������ �� �����Ҵ��IJ��缫�ĵ缫��ӦʽΪ ��
��2���ڴ˹����У��ҳ���ijһ�缫����������4.32gʱ���׳�����������������ΪmL����״���£���
��3�����ڳ��³�ѹ�£�1g C2H5OHȼ������CO2��Һ̬H2Oʱ�ų�29.71kJ������ʾ�÷�Ӧ���Ȼ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨij�л�������A�Ľṹ����������ʵ�飺
��1������ʽ��ȷ���� ��i�����л���A�����������г��ȼ�գ�ʵ���ã�����5.4g H2O��8.8g CO2 �� ��������6.72L����״���£�����������и�Ԫ�ص�ԭ�Ӹ������� ��
��ii���������Dzⶨ���л����������Է����������õ���ͼ����ʾ����ͼ��������Է�������Ϊ �� �����ʵķ���ʽ�� ��
��ii�����ݼۼ����ۣ�Ԥ��A�Ŀ��ܽṹ��д���ṹ��ʽ ��
��2���ṹʽ��ȷ���� 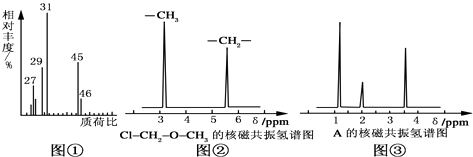
��i���˴Ź��������ܶ��л�������в�ͬλ�õ���ԭ�Ӹ�����ͬ�ķ�ֵ���źţ������ݷ�ֵ���źţ�����ȷ����������ԭ�ӵ��������Ŀ�����磺���ȼ��ѣ�Cl2��CH2��O��CH3����������ԭ����ͼ�ڣ����ⶨ���л���A�ĺ˴Ź�������ʾ��ͼ��ͼ�ۣ���A�Ľṹ��ʽΪ ��
��ii��A��һ����������ˮ������B��B�ɺϳɰ�װ����C����д��Bת��ΪC�Ļ�ѧ��Ӧ����ʽ�� ��
��iii�����������е��˶�Ա����Ť��ʱ����ҽ�漴�������飨�е�Ϊ12.27�棩�����˲�λ���оֲ��䶳����������Bѡ����ʵķ����Ʊ������飬Ҫ��ԭ��������Ϊ100%����д���Ʊ���Ӧ����ʽ�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com