
【题目】如图所示表示页岩气中某些烃类的结构模型:

(1)有机物甲的名称为____________,有机物甲与有机物乙互为____________。
(2)有机物乙的一氯取代物有________种,请你根据甲烷分子结构示意图推测,有机物乙中最多有________个C原子在同一平面内。
【答案】正丁烷 同分异构体 2 3
【解析】
(1)根据有机物甲的球棍模型可知,甲的结构简式为CH3—CH2—CH2—CH3,乙的结构简式为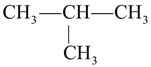 ,有机物甲和乙的分子式相同而结构不同,二者互为同分异构体;
,有机物甲和乙的分子式相同而结构不同,二者互为同分异构体;
(2) ![]() 分子中与“
分子中与“![]() ”相连的3个—CH3位置相同,取代效果相同,分子中含有2类氢原子,一氯代物有2种;
”相连的3个—CH3位置相同,取代效果相同,分子中含有2类氢原子,一氯代物有2种;![]() 相当于CH4分子中的3个H原子被3个—CH3取代,则最多有3个C原子在同一平面内。
相当于CH4分子中的3个H原子被3个—CH3取代,则最多有3个C原子在同一平面内。
(1)根据有机物甲的球棍模型可知,甲的结构简式为CH3—CH2—CH2—CH3,名称为正丁烷;根据有机物乙的比例模型可知,乙的结构简式为 ,有机物甲和乙的分子式相同而结构不同,二者互为同分异构体,故答案为:正丁烷;同分异构体;
,有机物甲和乙的分子式相同而结构不同,二者互为同分异构体,故答案为:正丁烷;同分异构体;
(2) ![]() 分子中与“
分子中与“![]() ”相连的3个—CH3位置相同,取代效果相同,分子中含有2类氢原子,一氯代物有2种(
”相连的3个—CH3位置相同,取代效果相同,分子中含有2类氢原子,一氯代物有2种(![]() 、
、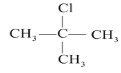 );根据CH4分子结构示意图可知,CH4分子中最多有3个原子在同一平面内,
);根据CH4分子结构示意图可知,CH4分子中最多有3个原子在同一平面内,![]() 相当于CH4分子中的3个H原子被3个—CH3取代,则最多有3个C原子在同一平面内,故答案为:2;3.
相当于CH4分子中的3个H原子被3个—CH3取代,则最多有3个C原子在同一平面内,故答案为:2;3.


科目:高中化学 来源: 题型:
【题目】中国是一个严重缺水的国家,污水治理越来越引起人们重视,可以通过膜电池除去废水中的乙酸钠和对氯苯酚,其原理如图所示,下列说法不正确的是

A. 电流方向从A极沿导线经小灯泡流向B极
B. B极为电池的阳极,电极反应式为CH3COO—— 8e + 4H2O ═ 2HCO3—+9H+
C. 当外电路中有0.2 mol e转移时,通过质子交换膜的H+的个数为0.2NA
D. A极的电极反应式为![]() + H++2e ═ Cl+
+ H++2e ═ Cl+ ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列6种物质
①![]() ②
②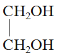 ③
③![]()
④CH3-CH=CH-CH3 ⑤![]() ⑥
⑥![]()
(1)用于制造炸药TNT的是____(填序号)。
(2)具有两性的是______(填序号)。
(3)有机物①的沸点比②______(填“高”或“低”)
(4)有机物④的名称是___________
(5)有机物④形成的高聚物结构简式为__________________
(6)检验有机物⑥中官能团的试剂是_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________。

(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水 |
B.容量瓶用水洗净后,再用待配溶液洗涤 |
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度_____0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为_______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“点击化学”是指快速、高效连接分子的一类反应,例如铜催化的Huisgen环加成反应:

我国科研人员利用该反应设计、合成了具有特殊结构的聚合物F并研究其水解反应。合成线路如下图所示:

已知:
![]()
(1)①的反应类型是___________,化合物  的官能团的名称为_____________。
的官能团的名称为_____________。
(2)关于B和C,下列说法不正确的是____________(填字母序号)。
a.利用红外光谱法可以鉴别B和C b.B可以发生氧化、取代、消去反应
c.可用溴水检验C中含有碳碳三键
(3)B生成C的过程中还有另一种生成物X,分子式为C3H6O,核磁共振氢谱显示只有一组峰,X的结构简式为______________________。
(4)D生成E的化学方程式为___________________________________________________。
(5)有机物M是有机物C的同系物,其相对分子质量比C大14,写出一种满足下列条件的M的同分异构体N的结构简式是________________________。
a.除苯环外,不含其它的环状结构,不考虑立体异构;
b.能与FeC13溶液发生显色反应;
c.1mol N最多与6mol Br2(浓溴水)反应。
(6)为了探究连接基团对聚合反应的影响,设计了单体K( ) 其合成路线如下,写出H、J的结构简式:H____________、J_______________。
) 其合成路线如下,写出H、J的结构简式:H____________、J_______________。
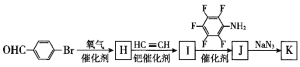
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或数据合理的是
A. 工业上常用热还原法冶炼铁和钠
B. 用NaOH溶液能一次鉴别分别含有Mg2+、Cu2+、和Na+的三种盐溶液
C. 从氯酸钾和二氧化锰制氧气后的混合物中分离出可溶物的操作步骤: 溶解→过滤→蒸馏
D. 量取16.80mLNa2CO3溶液可选用规格为20mL的量筒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示,下列说法正确的是
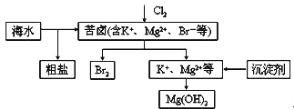
A. 得到的 Mg(0H)2 是耐火砖的主要成分
B. 粗盐可采用除杂和蒸馏等过程提纯
C. 工业生产中常选用 NaOH 作为沉淀剂
D. 富集溴一般先用空气或水蒸气吹出单质溴,再用碱液或SO2 等吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ实验室里需要纯净的氯化钠溶液,但实验室只有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如下方案进行提纯:

(1)操作②能否改为加硝酸钡溶液,______(填“能”或“否”) ,理由_____________________________。
(2)进行操作②后,如何判断SO42- 已除尽,方法是___________________。
(3)操作④的目的是_______________________________。
Ⅱ硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3mol/L H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1中,分离操作,所用到的玻璃仪器有___________________________。(填仪器编号)
①漏斗 ②分液漏斗 ③烧杯 ④广口瓶 ⑤铁架台 ⑥玻璃棒 ⑦酒精灯
(2)在步骤3中,“一系列操作”依次为_____________________、_______________________和过滤。
(3)实验室欲用18mol/L H2SO4来配制240mL 3mol/L H2SO4溶液,需要量取________mL浓硫酸,实验时,下列操作会造成所配溶液浓度偏低的是__________________。(填字母)
a.容量瓶内壁附有水珠而未干燥处理 b.未冷却至室温直接转移至容量瓶中
c.加水时超过刻度线后又倒出 d.定容时仰视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各溶液中有关微粒的物质的量浓度关系正确的是( )
A. 0.1 mol·L-1 NaHCO3溶液:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3)-c(CO32-)
B. 0.1 mol·L-1 NaHC2O4溶液呈酸性:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
C. 20 mL 0.10 mol·L-1 CH3COONa溶液与10 mL 0.10 mol·L-1 HCl溶液混合得到的酸性溶液:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
D. 向0.1mol·L-1 NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com