
| X | Y | ||
| W | Z | ||
| T |
| A. | X、Y、Z三种元素最简单氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性 | |
| D. | T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 |
分析 X、Y、W、Z为短周期元素,设W的最外层电子数为x,五种元素的原子最外层电子数之和为26,则x+x+(x+1)+(x+2)+(x+3)=26,解得x=4,结合元素的位置可知,W为Si,T为Ge,X为N,Y为O,Z为Cl,以此来解答.
解答 解:由上述分析可知,W为Si,T为Ge,X为N,Y为O,Z为Cl,
A.X、Y的氢化物含氢键,沸点均高于HCl,故A错误;
B.由X、Y和氢三种元素形成的化合物可能为硝酸铵,含离子键、共价键,故B错误;
C.SiO2、Si3N4均有熔点高、硬度大的特性,而SiCl4为分子晶体,熔点低、硬度小,故C错误;
D.T为第Ⅳ族元素,位于金属与非金属的交界处,T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4,故D正确;
故选D.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素化合物为解答的关键,侧重分析与应用能力的考查,注意晶体的性质,题目难度不大.


科目:高中化学 来源: 题型:填空题
 .(以上均用元素符号表示)
.(以上均用元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3?2H++CO32- | B. | NaHSO4?Na++HSO4- | ||
| C. | H2S+H2O?HS-+H3O+ | D. | Ca(OH)2?Ca2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 类别选项 | 碱 | 盐 | 电解质 | 非电解质 |
| A | 明矾 | 食盐 | 石墨 | 醋酸 |
| B | 纯碱 | CaCO3 | NH3•H2O | Fe |
| C | 烧碱 | 小苏打 | BaSO4 | 干冰 |
| D | KOH | CuSO4 | Na2SO4 | NaClO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
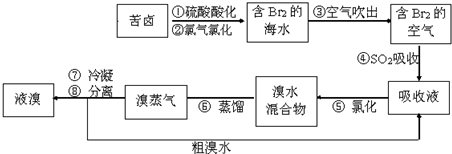
| A. | 步骤④⑤是为了富集溴 | |
| B. | 步骤③说明溴具有挥发性 | |
| C. | 步骤④的离子方程式为Br2+SO2+H2O═2H++2Br-+SO32- | |
| D. | 步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物可用分液漏斗分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2O3+3CO $\frac{\underline{\;\;△\;\;}}{\;}$2 Fe+3CO2 | B. | NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O | ||
| C. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O | D. | 4Fe (OH)2+O2+2H2O═4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
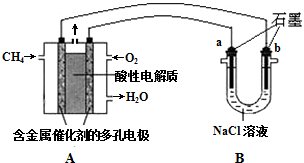
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com