
【题目】溶液的酸碱性可用酸度(AG)表示[AG=lgc(H+)/c(OH)]。室温下,向浓度均为0.1mol·L-1、体积均为100mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,AG随加入NaOH的物质的量的变化如图所示,下列叙述正确的是
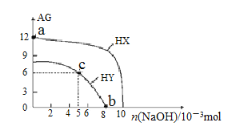
A. HX、HY均为弱酸
B. a点由水电离出的c(H+)=1.0×10-12mol·L-1
C. c点溶液中:c(HY) <c(Na+)<c(Y-)
D. b点时,溶液的pH=7,酸碱恰好完全中和
【答案】C
【解析】
A.根据起点:0.1mol/L的HX溶液:lgc(H+)/c(OH)=12,Kw=c(H+)×c(OH)=1×10-14,得出c(H+)=0.1mol/L,HX为强酸,故A错误;
B.a溶液中c(H+)=0.1mol/L,溶液中水电离的c(H+)=10-13molL-1,故B错误;
C.c点lgc(H+)/c(OH)=6,则溶液中c(H+)=10-4mol/L,此时消耗的NaOH为0.005mol,则溶液中的溶质为NaY和HY,由于溶液显酸性,所以HY的电离程度大于NaY的水解程度,所以n(Y-)>0.005mol,n(HY)<0.005mol,n(Na+)=0.005mol,所以c(HY) <c(Na+)<c(Y-),故C正确;
D.浓度均为0.1molL-1、体积均100mL的HY与NaOH恰好中和消耗NaOH为0.01mol,而b点时消耗的NaOH为0.008mol,所以酸过量,故D错误.
正确答案:C。


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】已知反应A(s)+3B(g)![]() 2C(g)+D(g),2min后,C的浓度增加0.4mol/L。下列关于该化学反应的说法不正确的是( )
2C(g)+D(g),2min后,C的浓度增加0.4mol/L。下列关于该化学反应的说法不正确的是( )
A.2min末,气体D在标准状况下的体积无法计算
B.用物质B、C、D来分别表示该反应的速率之比为3:2:1
C.由于A为纯固体,物质的量浓度是常数,故无法利用A的相关物理量的变化来表示该反应的速率大小
D.单位时间内,每消耗0.3molB气体,同时消耗0.1molD气体,此时该反应达到最大限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.28g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到VmL气体(标准状况),将盛有此气体的容器倒扣在水中,通入氧气恰好使气体完全溶解在水中,则需要标准状况下的氧气体积为( )
A. 504mLB. 336mLC. 224mLD. 168mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+2Ag。下列有关说法正确的是( )

A. 测量原理示意图中,电流方向从Cu流向Ag2O
B. 负极的电极反应式为2Cu+2OH--2e-=Cu2O+H2O
C. 电池工作时,OH-向正极移动
D. 2molCu与1molAg2O的总能量低于1molCu2O与2molAg具有的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用浓度为0.100 0 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.100 0 mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是
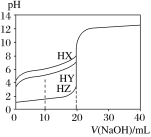
A. 在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX
B. 根据滴定曲线可得Ka(HX)的数量级是10-7
C. 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)
D. HY与HZ混合,达到平衡时c(H+)=Ka(HY).c(HY)/c(Y-)+c(Z-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些有机化合物的模型如图所示。回答下列问题:
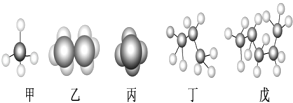
(1)属于比例模型的是___(填“甲”、“乙”、“丙”、“丁”或“戊”,下同)。
(2)表示同一种有机化合物的是___。
(3)存在同分异构体的是___,写出其同分异构体的结构简式___。
(4)含碳量最低的是___,含氢量最低的分子中氢元素的质量百分含量是___(保留一位小数)。
(5)C8H10属于苯的同系物的所有同分异构体共有___种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2016·天津卷) 下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(写元素符号)__________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol Y单质比1 mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1 mol X的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为69 ℃和58 ℃,写出该反应的热化学方程式:__________。
(5)碳与镁形成的1 mol化合物Q与水反应,生成2 mol Mg(OH)2和1 mol烃,该烃分子中碳氢质量比为9∶1,烃的电子式为__________。Q与水反应的化学方程式为__________。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1 L 2.2 mol/L NaOH溶液和1 mol O2,则两种气体的分子式及物质的量分别为__________,生成硫酸铜物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是
A. NH4HCO3![]() NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
B. NH3+HCl===NH4Cl
C. 2KOH+Cl2===KCl+KClO+H2O
D. 2K2O2+2CO2===2K2CO3+O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究浓硫酸的氧化性,用如图所示装置进行有关实验。

(1)装置A中发生反应的化学方程式为___,反应中体现了浓硫酸的___性和__性。
(2)装置D中试管口放置的棉花应用一种液体浸泡一下,这种液体是___,其作用是___。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象时,关闭弹簧夹K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中的现象是___。B中应放置的液体是___(填字母)。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和一定体积的18molL-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
下列药品中能用来证明反应结束后的烧瓶中有余酸的是___(填字母)。
a.铁粉 b.BaCl2溶液 c.银粉 d.Na2CO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com