
下列关于金属元素特征的叙述正确的是( )
A.金属元素的原子只有还原性,离子只有氧化性
B.金属元素在化合物中一定显正价
C.金属元素在不同化合物中化合价均不同
D.金属单质在常温下均是固体
科目:高中化学 来源: 题型:
一定质量的铁、氧化铁、氧化铜的混合物粉末放入100 mL4.40 mol/L盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28 g。过滤,滤液中无Cu2+。将滤液加水稀释到200 mL,测得其中c(H+)为0.400 mol/L。则原混合物中单质铁的质量是 ( )
A.2.4g B.10.08g C.3.36g D.5.60g
查看答案和解析>>
科目:高中化学 来源: 题型:
充分燃烧2.8g某有机物A,生成8.8g CO2和3.6g H2O,这种有机物蒸气的相对密度是相同条件下N2的2倍。
(1)求该有机物的分子式 。
(2)该有机物链状同分异构体的结构简式为(有几种就写几种,不一定填满): 、 、 、 。
(3)若有机物A在核磁共振氢谱中只有一个信号峰(即只有一种氢原子),则用键线式表示的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
分析下图中各物质的转化关系。
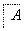
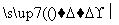
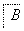
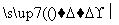
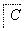
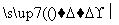
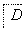
已知A是地壳中含量最高的金属元素单质。
(1)写出B、D的化学式:B________;D________。
(2)写出离子方程式:
C→D_______________________________________________________;
B+CO2→D__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
钛(Ti)因为具有神奇的性能越来越引起人们的关注。常温下钛不和非金属、强酸反应。红热时,却可与常见的非金属单质反应。钛是航空、军工、电力等方面的必需原料。地壳中含钛矿石之一是金红石(TiO2),目前大规模生产钛的方法是:第一步:金红石、碳粉混合,在高温条件下通入Cl2制得TiCl4和一种可燃性气体,该反应的化学方程式为______________________________,该反应的还原剂是________。
第二步:在氩气的气氛中,用过量的镁在加热条件下与TiCl4反应制得金属钛。
(1)写出此反应的化学方程式:_____________________________________________。
(2)简述从上述所得产物中获取金属钛的步骤___________________________ _______________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学欲在实验室中对Fe3+与I-的反应进行探究,实现Fe2+与Fe3+的相互转化。
(1)该同学最初的实验操作和现象如下:
| 编号 | 操作 | 现象 |
| Ⅰ | 先向2 mL 0.1 mol·L-1 FeCl2溶液中滴加KSCN溶液,再滴加新制氯水 | |
| Ⅱ | 先向2 mL 0.1 mol·L-1 FeCl3溶液中滴加KSCN溶液,再滴加0.1 mol·L-1 KI溶液 | 滴加KSCN溶液后,溶液变成血红色;滴加KI溶液后,血红色无明显变化 |
①实验Ⅰ的现象为___________________________________________________。
②FeCl2溶液与新制氯水反应的离子方程式为_____________________________
______________________________________________________________________。
(2)该同学分析了导致实验Ⅱ现象的可能原因,并对实验方案进行了改进。改进后的实验操作和现象如下:
| 编号 | 操作 | 现象 |
| Ⅲ | 向2 mL 0.1 mol·L-1 KI溶液中滴加1 mL 0.1 mol·L-1 FeCl3溶液,再滴加KSCN溶液 | 滴加FeCl3溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变成血红色 |
根据实验Ⅲ,该同学认为Fe3+有可能与I-发生氧化还原反应,请结合实验现象用简明的文字说明他得出上述结论的理由:_____________________________________。
(3)该同学认为需要进一步设计实验,证明根据实验Ⅲ中现象得出的结论。请补全下表中的实验方案:
| 编号 | 操作 | 预期现象及结论 |
| Ⅳ | 向2 mL 0.1 mol·L-1 KI溶液中滴加1 mL 0.1 mol·L-1 FeCl3溶液,__________ |
(4)上述实验结果表明,Fe3+有可能与I-发生氧化 还原反应。进一步查阅资料知,参加反应的Fe3+与I-的物质的量相同。该同学结合上述实验结论,分析了实验Ⅲ中加入KSCN后溶液变红的原因,认为Fe3+与I-反应的离子方程式应写为__________________________________________。
还原反应。进一步查阅资料知,参加反应的Fe3+与I-的物质的量相同。该同学结合上述实验结论,分析了实验Ⅲ中加入KSCN后溶液变红的原因,认为Fe3+与I-反应的离子方程式应写为__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠(NaNO2)的装置如下图所示(部分夹持装置略)。
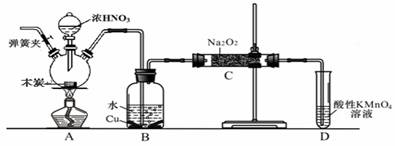
已知:室温下,①2NO+Na2O2 = 2NaNO2
②3NaNO2+3HCl == 3NaCl+HNO3+2NO↑+H2O
③酸性条件下,NO或NO2– 都能与MnO4–反应生成NO3– 和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式 。
(2) B中观察到的主要现象是有无色气体产生和 ,写出有关反应的离子方程式 ,D装置的作用是 。
(3)检验C中产物有亚硝酸钠的方法是 。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,为避免产生这些副产物应在B、C装置间增加装置,则该装置中盛放的药品名称 。
(5)将1.56g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
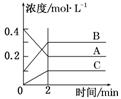 下图所示为800 ℃ 时A、B、C三种气体在密闭容器中反应时浓度的变化,只分析图形不能得出的结论是
下图所示为800 ℃ 时A、B、C三种气体在密闭容器中反应时浓度的变化,只分析图形不能得出的结论是
A.A是反应物
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C.达平衡后,若升高温度,平衡向正反应方向移动
D.反应的方程式为:2A(g)  2B(g) +C(g)
2B(g) +C(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com