
| A. | 因为 H-F 的键能大于 H-Cl,所以 HF 沸点高于 HCl | |
| B. | SO3是由极性键构成的非极性分子 | |
| C. | 氯化钠和氯化铯晶体中氯离子的配位数相同 | |
| D. | 第一电离能大小比较 Br>Se>As |
分析 A.HF分子间能形成氢键,根据氢键对物理性质的影响分析;
B.不同原子构成的共价键是极性键,分子中正负电荷中心重合,电荷分布均匀,则为非极性分子;
C.氯化钠晶体中氯离子配位数为6、氯化铯晶体中氯离子的配位数为8;
D.同周期,随原子序数增大第一电离能增大,但As原子的4p电子半满为稳定结构.
解答 解:A.HF分子间能形成氢键,HCl分子间不能形成氢键,氢化物中含有氢键的熔沸点较高,HF的沸点高于HCl,与分子内的共价键无关,故A错误;
B.SO3中S与O原子之间存在极性键,分子中正负电荷中心重合,电荷分布均匀,为非极性分子,故B正确;
C.氯化钠晶体中氯离子配位数为6、氯化铯晶体中氯离子的配位数为8,则氯化钠和氯化铯晶体中氯离子的配位数不相同,故C错误;
D.同周期,随原子序数增大第一电离能增大,但As原子的4p电子半满为稳定结构,则第一电离能Br>As>Se,故D错误.
故选B.
点评 本题考查了氢键、分子极性的判断、晶体的结构、第一电离能的比较,注意把握非金属性与电负性、第一电离能的关系及常见晶体的结构为解答的关键,侧重规律性知识的考查,题目难度不大.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:选择题
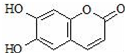
| A. | 与稀H2SO4混合加热不反应 | |
| B. | 不能使酸性高锰酸钾溶液褪色 | |
| C. | 1mol 瑞香素最多能与3mol Br2发生反应 | |
| D. | 1mol瑞香素与足量的NaOH溶液发生反应时,消耗NaOH 2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ | B. | Mg2+、Fe2+ | C. | Fe2+ | D. | Mg2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
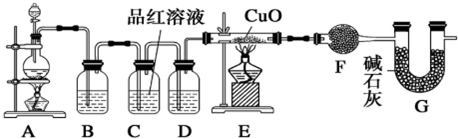
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiCl4、金刚石 | B. | H2S、NF3 | C. | CH2═CHCl、环已烷 | D. | C6H6(苯)、CH3C≡CH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.21mol | B. | 0.14mol | C. | 0.16mol | D. | 0.24mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中C1-浓度为2mo1•L-1 | |
| B. | 该溶液中Ba2+的物质的量是1mo1 | |
| C. | 可使用250mL容量瓶分两次完成490mL该浓度的BaCl2溶液的配制 | |
| D. | 将208gBaCl2固体溶解在1L水中,形成的溶液的浓度为1mo1•L-1 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上月考一化学卷(解析版)) 题型:选择题
高温下,某反应达平衡,平衡常数K=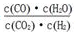 。恒容时,温度升高,H2浓度减小,下列说法正确的是
。恒容时,温度升高,H2浓度减小,下列说法正确的是
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO+H2O CO2+H2
CO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳-14 核素:148C | |
| B. | HClO 的结构式为 H-O-Cl | |
| C. | 化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种 | |
| D. | H2S、PH3、HCl、HF 的热稳定性依次增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com