
| A. | XeF6 | B. | BeC12 | C. | N2 | D. | BF3 |
分析 共价化合物分子中元素原子最外层电子数+|该元素化合价|(或共价键数目)=8,该元素原子满足8电子结构;
分子中若含有氢元素,则氢原子不能满足最外层8电子稳定结构,但它满足K层为最外层2个电子的稳定结构;
若为同种元素组成的分子,该元素原子的最外层电子数目与其在分子中形成的共价键的数目之和若为8,则其最外层满足8电子结构,反之不满足.
解答 解:A.XeF6分子中,Xe原子的最外层已经达到8电子稳定结构,与F原子形成共价键,分子中最外层电子数大于8,故A错误;
B.BeCl2分子Be原子最外层电子数为2+2=4,不满足8电子结构,故B错误;
C.N2中含有三键,其结构式为N≡N,N原子的最外层电子8,满足8电子稳定结构,故C正确;
D.BF3中,B元素位于第ⅢA族,则3+3≠8,不满足分子中所有原子都满足最外层8电子结构,故D错误;
故选C.
点评 本题考查原子核外电子排布,题目难度不大,掌握8电子结构判断的方法为解答关键,注意利用化合价(共价键数目)与最外层电子数来分析,试题培养了学生的分析能力及灵活应用能力.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:解答题
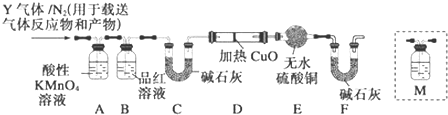
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l) | B. | H2(g)+Cl2(g)═2HCl(g) | ||
| C. | (NH4 )2 CO3(s)═NH4HCO3(s)+NH3(g) | D. | Cu(s)+Cl2(g)═CuCl2(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


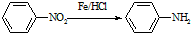 (苯胺,易被氧化)
(苯胺,易被氧化) ,F→G的反应类型是氧化反应.
,F→G的反应类型是氧化反应. .
. 的同分异构体的结构简式
的同分异构体的结构简式 .(写出2种)
.(写出2种) ,请设计合成路线,要求不超过4步(无机试剂任选).注:合成路线的书写格式参照如下示例流程图:CH3CHO$→_{催化剂}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4}}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
,请设计合成路线,要求不超过4步(无机试剂任选).注:合成路线的书写格式参照如下示例流程图:CH3CHO$→_{催化剂}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4}}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
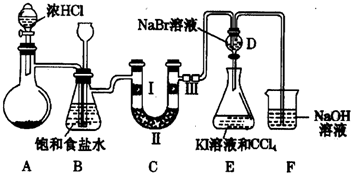
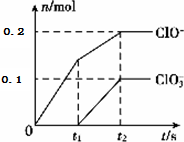
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
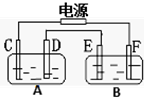
| A. | A池为电解池,B池为原电池 | B. | D、E两极都发生氧化反应 | ||
| C. | F极应为纯铜板材料 | D. | B池中E极质量增加12.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 金属 质量/g | 金属状态 | c(H2SO4) /mol•L-1 | V(H2SO4)/mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 4 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com