
NA���������ӵ�������ֵ������������ȷ����
A����������1LpH=1�Ĵ�����Һ�м�ˮ��������Һ��H+��Ŀ����0.1NA
B��60g�����������Ҵ�����������Ӧ����ַ�Ӧ����ѵ�C-O����ĿΪNA
C��ij��ˮ�Ҵ������������Ʒ�Ӧ����5.6LH2�����Ҵ������й��ۼ�����Ϊ4NA
D����֪C2H4(g)+H2(g)=C2H6(g)��H=-137.0kI/mol����ϩ��H2�ӳ�ʱ�ų�68.5kJ��������Ӧ�����б��ƻ���̼ԭ��֮�乲�õ��Ӷ���ĿΪNA

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ��һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���������У����ڹ��ۻ��������
A��H2 B��HCl C��NaCl D��NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ɳ�и߶��µ��Ĵΰ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
ij���������л������ֻ��̼���⡢������Ԫ�أ���Է�������Ϊ58����ȫȼ��ʱ���������ʵ�����CO2��H2O�������ܵĽṹ���У������������칹�� �� ��
A��4�� B��5�� C��6�� D��7��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ɳ�и߶��µ��Ĵΰ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ���ǣ� ��
A��s����d����ds�����ǽ���Ԫ�� B��p����������Ԫ��
C����������IIIB��Ԫ��������� D������������Ϊ2��Ԫ�ض��ֲ���s��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ɽ��ʡ����5���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
������ؿ�������������������ѧ��ѧ����������������ҵ�ϣ������̿��Ƹ�����ص��������£�

��ش��������⣺
��1������������Ҫ������CO2���壮д��ʵ������ȡCO2�Ļ�ѧ����ʽ ��
��2��KMnO4ϡ��Һ��һ�ֳ��õ���������������ԭ��������������ͬ���� ������ĸ����
a��75%�ƾ� b��˫��ˮ c������ d�� 84����Һ��NaClO��Һ��
��3��д���������̺�����������������ͨ�����ʱ��������Ҫ��ѧ��Ӧ�ķ���ʽ�� ��
��4�����������п���ѭ��ʹ�õ������� �� ��д��ѧʽ����
��5���ⶨ���������Ʒ���Ȳ��������̵ζ�������������Һ�еμ���������Һ��������ɫ����������Һ���Ϻ�ɫ�պ���ɫ�Ұ���Ӳ��ָ��������ﵽ�ζ��յ㡣д���÷�Ӧ�����ӷ���ʽ�� ��
��6����֪�������£�Ksp[Mn��OH��2]=2.4��10-13����ҵ�ϣ�����pH���Գ�����ˮ��Mn2+����pH=10ʱ����Һ��c��Mn2��= ___________________��
��7��������������� �����������KMnO4��K2CO3���������ܽ����ϵIJ��죬���� ����������裩�����ȹ��˵õ�KMnO4�־��壮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ����5�¸߿�ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ������
����ѧ��ѡ��2����ѧ�뼼����
������������Ni2O3����һ����Ҫ�ĵ���Ԫ�����Ϻ����ز��ϡ���ҵ�����ú������ϣ����������ơ�þ�Ͻ�Ϊ������ȡ��������NiC2O4��2H2O�����ٸ������ղ�������ȡ��������������֪����ĸơ�þ�����ξ�������ˮ����������ͼ������ʾ��
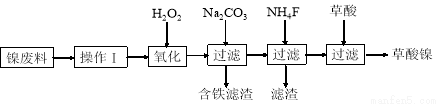
��ش��������⣺
��1��������Ϊ ��
��2���ټ���H2O2��������Ҫ��Ӧ�����ӷ���ʽΪ ��
�ڼ���̼������Һ��pH��4.0~5.0����Ŀ��Ϊ ��
��3����������NiC2O4��2H2O�����ȿ����и�����ˮ���ڸ��������գ����Ƶ�Ni2O3��ͬʱ��û�����塣NiC2O4���ȷֽ�Ļ�ѧ����ʽΪ ��
��4����ҵ�ϻ����õ�ⷨ��ȡNi2O3����NaOH��Һ��NiCl2��Һ��pH��7.5����������Na2SO4�����ö��Ե缫��⡣�������в�����Cl2��80%������������������ClO-���ٰѶ���������Ϊ��������ClO-����Ni(OH)2����Ni2O3�����ӷ���ʽΪ ��a mol������ȫ��ת��Ϊ������ʱ�����·��ͨ�����ӵ����ʵ���Ϊ ��
��5����Al��NiO(OH)Ϊ�缫��NaOH��ҺΪ���Һ���һ�����͵�أ��ŵ�ʱ��NiO(OH)ת��ΪNi(OH)2���õ�ط�Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡ����5�¸߿�ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
ʯīϩ�ɿ�����ʯī�IJ�״�ṹһ��һ��ذ����õ��ĵ���̼ԭ�ӣ�ʯīȲ��ƽ����״�ṹ��ȫ̼���ӣ����������Ļ�ѧ�ȶ��ԺͰ뵼�����ܣ���������H2���ᴿ���������⻯��ʯīϩ���е����Ǿ����У�ʹÿ��̼ԭ�Ӷ�����һ����ԭ�ӿɵ���ľ�Ե�²���ʯī�顣�����й�˵���в���ȷ����
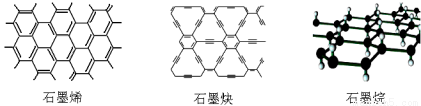
A��ʯīϩ��ʯīȲ��Ϊͬ��������
B��ʯīȲ��������������������뵼�����
C��12gʯīϩ��ȫת��Ϊʯī��������11.2L����
D��ʯīȲ���Դ���H2���ӵ�ֱ����������������H2�ᴿ��Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���Ĵ��ɶ����и�һ�¿κ���ҵ��ϩ��ѧ�Ծ��������棩 ���ͣ������
����A��B��C�������������ģ������ͼ��
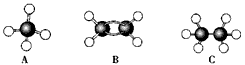
��1��������������������ȫȼ��ʱ��ȥO2����������________(���Ӧ��ĸ����ͬ)��
��2��ͬ״����ͬ�������������������ȫȼ��ʱ��ȥO2����������____________��
��3����������������������ȼ��ʱ�����ɶ�����̼������________������ˮ������________��
��4����120�桢1.01��105 Pa��ʱ����������̬����������������ϵ�ȼ����ͬ�����²�÷�Ӧǰ���������û�з����仯��������������__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�����ʡʦ��һ������5���¿����ۻ�ѧ�Ծ��������棩 ���ͣ������
���в�ͬ��̬���������NO��N2O3��NO2�� N2O5�ȣ�������һ�������¿����ת����
��1����֪��2NO(g)+O2(g) =2NO2(g)��H1=-113kJ/mol
NO(g)+O3(g)=NO2(g)+O2(g) ��H2=-199 kJ/mol
4NO (g)+O2(g) =2N2O5(g) ��H4=-57 kJ/mol
��Ӧ6NO2 (g)+O3(g)=3N2O5(g) ��H=__________��
��2��ij�¶���.��һ����ɱ���ܱ������г���1mol N2O3��������ӦN2O3 NO2(g)+NO(g)���ﵽƽ�����t1ʱ�̸ı�ijһ������������ʱ��ı仯ͼ����ͼ��ʾ���й�˵����ȷ����__________
NO2(g)+NO(g)���ﵽƽ�����t1ʱ�̸ı�ijһ������������ʱ��ı仯ͼ����ͼ��ʾ���й�˵����ȷ����__________
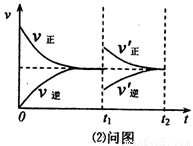
A��t1ʱ�̸ı������������N2O3��Ũ�ȣ�ͬʱ��СNO2��NO��Ũ��
B��t1ʱ�̸ı�������ƽ��������Ӧ�����ƶ���N2O3��ת��������
C����t2ʱ�̴ﵽ�µ�ƽ���NO2�İٷֺ�������
D����t1ʱ�̽������������С��ԭ�ݻ���һ�룬������~ʱ��ͼ������ͼ��ͬ
��3����1000K�£���ij���������з������з�Ӧ��2NO2(g)  2NO(g)+O2(g)����һ������NO2��������ܱ������У������ƽ��ת���ʦ�(NO2)���¶ȱ仯��ͼ��ʾ��ͼ��a���Ӧ�¶���.��֪NO2����ʼѹǿP0Ϊ120kPa����ʽ������¶��·�Ӧ��ƽ�ⳣ��Kp= __________(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������).
2NO(g)+O2(g)����һ������NO2��������ܱ������У������ƽ��ת���ʦ�(NO2)���¶ȱ仯��ͼ��ʾ��ͼ��a���Ӧ�¶���.��֪NO2����ʼѹǿP0Ϊ120kPa����ʽ������¶��·�Ӧ��ƽ�ⳣ��Kp= __________(��ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������).


��4�����ڷ�ӦN2O4(g) 2NO2(g)����һ��������N2O4��NO2����������������ѹǿ����ڹ�ϵ��v(N2O4)=k1��p(N2O4)��v(NO2)=k2��p2 (NO2)�����У�k1��k2���뷴Ӧ���¶��йصij�������Ӧ������-ѹǿ��ϵ��ͼ��ʾ��һ���¶��£�k1��k2��ƽ�ⳣ��Kp��Ĺ�ϵ��k1=____________������ͼ������У�ָ���ܱ�ʾ��Ӧ�ﵽƽ��״̬�ĵ�__________��������__________��
2NO2(g)����һ��������N2O4��NO2����������������ѹǿ����ڹ�ϵ��v(N2O4)=k1��p(N2O4)��v(NO2)=k2��p2 (NO2)�����У�k1��k2���뷴Ӧ���¶��йصij�������Ӧ������-ѹǿ��ϵ��ͼ��ʾ��һ���¶��£�k1��k2��ƽ�ⳣ��Kp��Ĺ�ϵ��k1=____________������ͼ������У�ָ���ܱ�ʾ��Ӧ�ﵽƽ��״̬�ĵ�__________��������__________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com