
| A. | HCl | B. | NaOH | C. | CuSO4 | D. | KNO3 |
分析 用惰性电解电解质溶液时,分为电解电解质型、电解水型、电解电解质和水型;用石墨作电极电解1mol/L下列物质的溶液,则电解前后溶液的pH保持不变,说明属于电解水型且电解质为强酸强碱盐,酸为含氧酸,据此分析解答.
解答 解:A.电解HCl溶液时,阳极上氯离子放电、阴极上氢离子放电,所以属于电解电解质型,导致溶液中氢离子浓度减小,溶液的pH增大,故A不选;
B.电解NaOH溶液时,实质上是电解水型,但电解后NaOH浓度增大,溶液的pH增大,故B不选;
C.电解硫酸铜溶液时,阴极上铜离子放电、阳极上氢氧根离子放电,所以是电解电解质和水型,导致溶液中氢离子浓度增大,溶液的pH变小,故C不选;
D.电解硝酸钾溶液时,阳极上氢氧根离子放电、阴极上氢离子放电,所以是电解水型,硝酸钾是强酸强碱盐,其浓度大小不影响溶液pH,故D选;
故选D.
点评 本题考查电解原理,为高频考点,明确电解时阴阳极放电离子顺序及电解后溶液离子浓度变化是解本题关键,注意基础知识的总结和归纳,题目难度不大.


 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 清晨,在茂密的树林中,可以看到从枝叶间透过的一道道光柱 | |
| B. | 工厂里用静电除尘 | |
| C. | 氨水和氯化铁溶液反应,生成氢氧化铁沉淀 | |
| D. | 不同品牌的墨水混用,导致钢笔出现堵塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
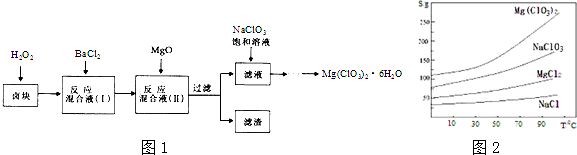
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
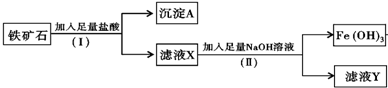
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将苯逐滴滴入浓硝酸和稀硫酸的混合液中,并用沸水浴加热制取硝基苯 | |
| B. | 油脂的提纯中,可将油脂加入浓NaOH 溶液加热,然后过滤,从滤液中可得较纯的油脂 | |
| C. | 将铜丝在酒精灯上加热到红热后,立即伸入无水乙醇中,反复操作多次,可制得乙醛 | |
| D. | 淀粉用酸催化水解后的溶液加入银氨溶液,水浴加热,可看到有银镜出现 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com