
 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)= 。平衡时H2的转化率为 。?
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)= 。平衡时H2的转化率为 。? 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:?
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:?| T/℃ | 200 | 300 | 400 |
| K | K1 | K3 | 0.5 |
 N2(g)+3H2(g)的化学平衡常数为 。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正 v(N2)逆(填“<”“>”或“=”)。?
N2(g)+3H2(g)的化学平衡常数为 。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正 v(N2)逆(填“<”“>”或“=”)。?

科目:高中化学 来源:不详 题型:单选题
 2Z(g) △H<
2Z(g) △H< ,如图是反应达平衡及改变条件平衡移动的图像。下列说法错误的是
,如图是反应达平衡及改变条件平衡移动的图像。下列说法错误的是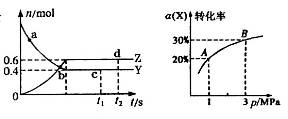
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 CO2(g)+H2(g) ΔH< 0
CO2(g)+H2(g) ΔH< 0
| A.增大反应物中CO的浓度 |
| B.降低反应温度 |
| C.将密闭容器体积压缩至一半 |
| D.加入适宜的催化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.正反应进行的程度大,正反应速率一定大 |
| B.化学平衡发生移动时,化学反应速率一定变化 |
| C.化学反应速率变化时,化学平衡一定发生移动 |
| D.只有催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法,其中正确的是( )
2C(g)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法,其中正确的是( )| A.用物质A表示的反应平均速率为0.3 mol·L-1·s-1 |
| B.用物质B表示的反应的平均速率为0.6 mol·L-1·s-1 |
| C.2s时物质A的转化率为70% |
| D.2s时物质B的浓度为0.7 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g) △H=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如下图:
2NH3(g) △H=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如下图:
| A.t1时增大了压强 |
| B.t2时同倍数增加N2、H2的物质的量 |
| C.t3时降低了温度 |
| D.t4时增大了c(NH3) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g) ΔH<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )
2SO3(g) ΔH<0,下图表示SO2的转化率与温度的关系,图上标有A、B、C、D、E五个点,其中能表示反应未达到平衡状态,且正反应速率大于逆反应速率的是( )
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com