
| A. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要加入过量的氧气 | |
| D. | H2、I2、HI平衡混合气加压后颜色变深 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,勒夏特列原理适用于所有的可逆反应,勒夏特列原理不适用于非可逆反应,据此分析解答.
解答 解:A、A.向硫氰化铁溶液中加入硫氰化钾固体时,硫氰根离子浓度增大,平衡向正反应方向移动,则硫氰化铁浓度增大,溶液的颜色变深,能用勒沙特列原理解释,故A不选;
B、二氧化氮生成四氧化二氮是反应后气体的系数和减小的反应,增大压强,平衡正向移动,颜色变浅,能用勒沙特列原理解释,故B不选;
C、存在平衡2SO2+O2(g)?2SO3(g),加入过量的空气,平衡向正反应方向移动,提高二氧化硫的转化率,能用勒夏特利原理解释,故C不选;
D、由H2、I2蒸气、HI组成的平衡体系加压后碘蒸气浓度增大,所以颜色变深,压强不影响该反应的平衡移动,所以不能用勒夏特里原理解释,故D选;
故选D.
点评 本题考查勒夏特里原理,侧重考查基本理论,明确勒夏特里原理适用范围即可解答,知道勒夏特里原理内涵,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
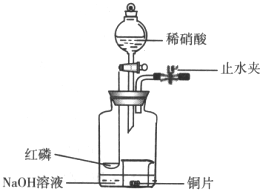 用如图示装置制备NO并验证其还原性.
用如图示装置制备NO并验证其还原性.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,F元素原子的电子排布式1s22s22p63s23p5,E元素的原子结构示意图是
,F元素原子的电子排布式1s22s22p63s23p5,E元素的原子结构示意图是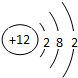
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH的物质的量浓度为0.1mol/L | B. | Na+ 的物质的量浓度为1mol/L | ||
| C. | 含4g氢氧化钠 | D. | 含0.1mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
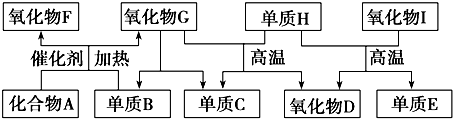
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有② | B. | 只有④ | C. | ①和④ | D. | ①和⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴水褪色,乙醇使酸性KMnO4溶液褪色,两者化学反应类型相同 | |
| B. | 1mol乙烯和Cl2完全加成后,再与Cl2彻底取代,两过程共消耗5mol Cl2 | |
| C. | 化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示 | |
| D. | 共价化合物中一定含有共价键,可能含有离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com