
下列说法正确的是( )
A.若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023
B.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7
C.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
D.一定条件下反应N2+3H2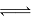 2NH3达到平衡时,3v正(H2)=2v逆(NH3)
2NH3达到平衡时,3v正(H2)=2v逆(NH3)
【答案】C
【解析】A、2 H2O2=2H2O+O2,生成1molO2,转移电子物质的量为2×6.02×1023,故错误;B、醋酸是弱酸,氢氧化钠是强碱,等体积混合醋酸过量,水溶液显酸性,pH<7,故错误;C、牺牲阳极的阴极保护法,是根据原电池原理,让比铁活泼的金属作负极,钢铁做正极,阴极保护法,是根据电解池,钢铁做阴极,可以防止钢铁的腐蚀,故正确;D、要求方向是一正一逆,且反应速率之比等于系数之比,2v正(H2)=3v逆(NH3),故错误。
H2O2=2H2O+O2,生成1molO2,转移电子物质的量为2×6.02×1023,故错误;B、醋酸是弱酸,氢氧化钠是强碱,等体积混合醋酸过量,水溶液显酸性,pH<7,故错误;C、牺牲阳极的阴极保护法,是根据原电池原理,让比铁活泼的金属作负极,钢铁做正极,阴极保护法,是根据电解池,钢铁做阴极,可以防止钢铁的腐蚀,故正确;D、要求方向是一正一逆,且反应速率之比等于系数之比,2v正(H2)=3v逆(NH3),故错误。
【考点定位】考查氧化还原反应中电子转移、盐类水解和弱电解质的电离、金属防护、达到化学平衡的判断等知识。
【名师点睛】对化学原理的考查,涉及氧化还原反应、盐类水解和弱电解质的电离、达到化学平衡的标志、金属腐蚀的防护等原理,要求平时学习注意化学反应原理,体现化学的特点,学生学习化学反应实质,可以培养学生分析问题的能力。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
A.1丁烯、2丁烯都存在顺反异构
B.1氯丙烷和2氯丙烷的消去产物相同
C.正戊烷、异戊烷、新戊烷的沸点逐渐降低
D.淀粉、纤维、脂肪、蛋白质都是天然高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
将pH=1的盐酸平均分成两份,一份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液,pH都升高了1,则加入的水与NaOH溶液的体积比为( )
A.9 B.10 C.11 D.12
查看答案和解析>>
科目:高中化学 来源: 题型:
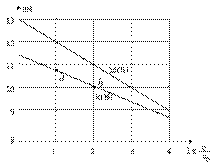 浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随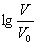 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当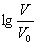 =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则 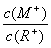 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,在10mL浓度均为0.1mol/LNaOH和NH3·H2O混合溶液中,滴加0.1mol/L的盐酸,下列有关溶液中粒子浓度关系正确的是( )
A.未加盐酸时:c(OH-)>c(Na+)= c(NH3·H2O)
B.加入10mL盐酸时:c(NH4+) +c(H+) = c(OH-)
C.加入盐酸至溶液pH=7时:c(Cl-) = c(Na+)
 D.加入20mL盐酸时:c(Cl-) =c(NH4+) +c(Na+)
D.加入20mL盐酸时:c(Cl-) =c(NH4+) +c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 ______ 。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-) 关系如右图(忽略溶液体积的变化、H2S的挥发)。
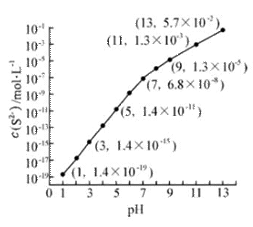
①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1.
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3) 25℃,两种酸的电离平衡常数如右表。
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K= 。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是( )
|
| 0.600 | 0.500 | 0.400 | 0.300 |
| 318.2 | 3.60 | 3.00 | 2.40 | 1.80 |
| 328.2 | 9.00 | 7.50 | a | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
A.a=6.00 B.同时改变反应温度和蔗糖的浓度,v可能不变
C.b<318.2 D.不同温度时,蔗糖浓度减少一半所需的时间相同
查看答案和解析>>
科目:高中化学 来源: 题型:
在10mL0.01mol/L的纯碱溶液中,不断搅拌并逐滴加入1.2mL 0.05mol/L盐酸,完全反应后在标准状况下生成二氧化碳的体积为()
| A. | 0mL | B. | 0.672mL | C. | 1.34mL | D. | 2.240mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知450℃时,2SO2(g)+O2(g) 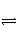
 2SO3(g) ΔH=-Q1。在相同条件下,向一密闭容
2SO3(g) ΔH=-Q1。在相同条件下,向一密闭容
器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2,则Q1、Q2满足的关系是
( )
A.Q2=Q1/2 B.Q2<Q1/2 C.Q2>Q1/2 D.不能确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com