
| A. | 2.24L | B. | 4.48L | C. | 5.6L | D. | 11.2L |
分析 由质量守恒定律可知E的质量,E的密度是H2密度的15.5倍,则相对分子质量为31,可计算物质的量浓度,进而根据V=nVm,计算体积.
解答 解:已知10.2g A与12.8g B完全反应,生成9.6g C和7.2g D及另一气体E,
m(E)=10.2g+12.8g-9.6g-7.2g=6.2g,
E的密度是H2密度的15.5倍,则相对分子质量为31,
n(E)=$\frac{6.2g}{31g/mol}$=0.2mol,
V(E)=0.2mol×22.4L/mol=4.48L.
故选B.
点评 本题考查化学方程式的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意从质量守恒的角度解答,把握相关计算公式.


科目:高中化学 来源: 题型:选择题
| A. | 20℃时,1mol SO2的体积一定大于22.4L | |
| B. | 常温常压下,1mol CO2与18 g H2O所含有的原子总数均为3 NA | |
| C. | 1mol/LNaCl溶液表示1L水中含有NaCl 58.5g | |
| D. | 标准状况下,11.2L NO与5.6 L O2形成的混合气体中含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
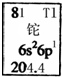
| A. | 铊元素的质量数是81 | B. | 铊原子的电子数为3 | ||
| C. | 铊原子的相对原子质量是204.4 | D. | 铊的金属性比铝的金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属单质可能与非金属、酸、盐溶液发生反应 | |
| B. | 酸性氧化物能与碱反应且大部分能与水化合成酸 | |
| C. | 碱性氧化物能与酸反应且都能与水化合成碱 | |
| D. | 酸能与金属、碱性氧化物、碱、某些盐溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3 K2SO4 K2CO3 K3PO4 | B. | NaOH KOH Ba(OH)2 Ca(OH)2 | ||
| C. | Na2O K2O CaO CO2 | D. | HNO3 H2SO4 H3PO4 HClO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 仪器标号 | 1 | 2 | 3 | 4 | 5 |
| 试剂标号 | E | AFG | C | G | I |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)中一种重要的掺杂剂.实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)
半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)中一种重要的掺杂剂.实验室要用黄磷(白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如下图所示:(部分夹持装置略去)| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| PCl5 | 2 | 105.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
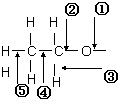 乙醇分子中各化学键如图所示:
乙醇分子中各化学键如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com