
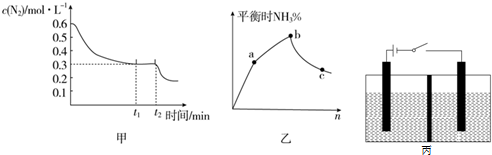
分析 (1)根据速率之比等于化学计量数之比,然后根据速率的计算公式求出时间;根据影响化学平衡的因素来解答;当N2与H2的起始体积比符合方程式中化学计量数之比时,达到平衡时氨的体积分数最大;根据浓度商和化学平衡常数比较,判断化学平衡移动方向,进而判断平衡建立过程中NH3的浓度变化趋势;
(2)N2H4是二元弱碱,其性质与氨气相似,第一步电离出1个氢氧根离子和N2H5+,则第二步中N2H5+电离出1个氢氧根离子和N2H62+;
(3)依据盖斯定律,结合题干热化学方程式计算写出;
(4)①由N2O4制取N2O5需要失去电子,所以N2O5在阳极区生成,即左室为阳极,右室为阴极;
②1mol液态CH3OH变成气态CH3OH需吸热11KJ,1mol液态水变成气态水需吸热44KJ,结合CH3OH(g)的燃烧热△H为-651kJ/mol求解CH3OH(l)的燃烧热,电池的能量效率=电池所产生的最大电能与电池所释放的全部能量之比,根据液态甲醇的燃烧热计算0.5mol甲醇完全燃烧放出的热量,结合原电池产生的电能计算;
解答 解:(1)①0~t1 min内,v(H2)=0.03mol•L-1•min-1,则v(N2)=0.01mol•L-1•min-1,则v=$\frac{△c}{△t}$=$\frac{0.3mol•{L}^{-1}}{{t}_{1}min}$=0.01mol•L-1•min-1,解得t1=30 min;
从t2min起N2的浓度逐渐减小,可能是降低温度或增大H2浓度使平衡正向移动引起的;
当N2与H2的起始体积比符合方程式中化学计量数之比时,达到平衡时氨的体积分数最大,即图乙中,b点时n=3;
故答案为:30 min;降低温度或增大H2浓度;3;
②c(H2)=0.1mol•L-1,c(N2)=0.5mol•L-1,c(NH3)=0.1mol•L-1,则Qc=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$=$\frac{0.{1}^{2}}{0.5×0.{1}^{3}}$=20>10,所以反应逆向进行,NH3的浓度逐渐减小;
故答案为:逐渐减小;
(2)N2H4是二元弱碱,其电离分步进行,第一步N2H4部分电离出OH-、N2H5+,电离方程式为:N2H4+H2O?N2H5++OH-,则第二步中N2H5+在溶液中部分电离出出OH-、N2H62+,电离方程式为:N2H5++H2O?N2H62++OH-;
故答案为:N2H4+H2O?N2H5++OH-;N2H5++H2O?N2H62++OH-;
(3)①N2(g)+2O2(g)=N2O4(l)△H1=-195kJ?mol-1
②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
根据盖斯定律可知反应②×2-反应①即得到反应:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4 kJ•mol-1;
故答案为:2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g)△H=-873.4 kJ•mol-1;
(4)①装置图中与电源正极相连的电极为阳极,与电源负极相连的电极为阴极,从电解原理来看,N2O4制备N2O5为氧化反应,则N2O5应在阳极区生成,故生成N2O5的左室为阳极,右室为阴极,生成N2O5的反应式为N2O4+2HNO3-2e-=2N2O5+2H+;
故答案为:b;N2O4+2HNO3-2e-=2N2O5+2H+;
②1mol液态CH3OH变成气态CH3OH需吸热11KJ,CH3OH(g)=CH3OH(l)△H=-11KJ/mol①,1mol液态水变成气态水需吸热44KJ,H2O(g)=H2O(l)△H=-44KJ/mol②,CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H=-651kJ•mol-1③,则③-①+②×2得:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=(-651KJ/mol+11KJ/mol-88KJ/mol)=-728KJ/mol,理想状态下,该燃料电池消耗0.5molCH3OH(1)产生的热量为$\frac{728KJ}{2}$=364KJ,所以该燃料电池的理论效率为$\frac{345.8kJ}{364KJ}$×100%=95%;
故答案为:95%;
点评 本题考查反应速率、化学平衡、反应热的有关计算,电极反应书写,侧重于学生的分析能力和计算能力的考查,注意Qc和K之间的大小关系是判断反应方向的依据,题目难度中等.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
下列实验操作、现象和结论均正确的是( )
选项 | 实验操作 | 现象 | 结 |
A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁都有水珠 | 两种物质均受热分解 |
B | 向稀的苯酚水溶液中滴加饱和溴水 | 生成白色沉淀 | 产物三溴苯酚不溶于水 |
C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 还原性:Cl- > I- |
D | 向FeSO4溶液中先滴入KSCN溶液再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+既有氧化性又有还原性 |
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:选择题
向含有c(FeCl3)=0.2 mol·L-1、c(FeCl2)=0.1 mol·L-1的混合溶液中滴加稀NaOH溶液,可得到一种黑色分散系,其中分散质粒子是直径约为9.3 nm的金属氧化物,下列有关说法中正确的是
A.该分散系的分散质为Fe2O3
B.在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷
C.可用过滤的方法将黑色金属氧化物与Na+分离开
D.加入NaOH时发生的反应可能为:Fe2++2Fe3++8OH-=Fe3O4+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙苯催化脱氢生产苯乙烯的反应:
乙苯催化脱氢生产苯乙烯的反应: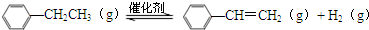
化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| 总压强/100kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 前10min反应的平均速率v(C)=0.1 mol/(L•min) | |
| B. | 反应达到平衡时B的平衡浓度是1.5 mol•L-1 | |
| C. | 恒温下,将反应容器体积压缩为原来的一半,则D的平衡浓度小于1.0 mol•L-1 | |
| D. | 10 min后在容器中加入A,重新建立平衡时A的转化率一定大于50% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| n(HI)/mol | 1.80 | 1.64 | 1.52 | 1.44 | 1.40 | 1.40 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com