
| A、K2MnO4 |
| B、MnO2 |
| C、MnCl2 |
| D、Mn |


科目:高中化学 来源: 题型:
A、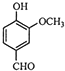 |
B、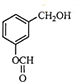 |
C、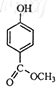 |
D、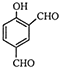 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Ca2+、Cl-、SO42- |
| B、Fe2+、H+、SO32-、ClO- |
| C、Mg2+、NH4+、Cl-、SO42- |
| D、K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子式为C4H8含碳碳双键的同分异构体(包括顺反异构)共有5种 |
| B、甲苯能使酸性高锰酸钾溶液褪色,而甲基环己烷不能,说明有机物分子中的基团间存在相互影响 |
C、芥子醇(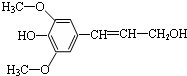 )能发生氧化、取代、水解、加聚反应 )能发生氧化、取代、水解、加聚反应 |
| D、将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热后有银镜生成,该物质一定属于醛类 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H6 |
| B、C4H8O2 |
| C、C3H10O |
| D、C5H10O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
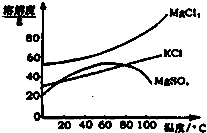 某类硝酸盐受热分解的产物为不含氮元素的固体物质和NO2、O2气体:
某类硝酸盐受热分解的产物为不含氮元素的固体物质和NO2、O2气体:查看答案和解析>>
科目:高中化学 来源: 题型:
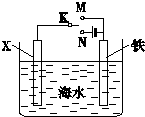 (1)利用如图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于
(1)利用如图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com