
| A、c(NH4+)>c(Cl-) |
| B、c(H+)=c(OH-) |
| C、c(NH4+)+c(NH3?H2O)>c(Cl-) |
| D、c(NH4+)>c(Cl-)+c(OH-) |


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
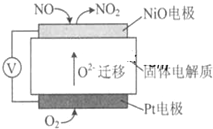 SO2、NOx是大气的主要污染物.
SO2、NOx是大气的主要污染物.查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、NaCl |
| B、Cl2 |
| C、NaClO |
| D、HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 主要实验步骤及实验现象 |
| ① | 在含有B的溶液中,加入稀H2S04,产生浅黄色浑浊和无色有刺激性气味的气体. |
| ② | 20 ml沸水中滴加F的饱和溶液1~2ml,所得液体呈红褐色 |
| ③ | 将实验②得到的红褐色液体加热蒸发、灼烧,最终得到红棕色固体 |
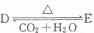 ,若有D和E?XH20的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为
,若有D和E?XH20的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、8.90×10-6mol/L |
| B、1.36×10-5mol/L |
| C、1×10-5mol/L |
| D、4.45×10-2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④⑤ | B、①②④⑥ |
| C、②③④⑤⑥ | D、①②③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com