
【题目】500℃,在三个相同体积的恒容密闭容器里,分别加入对应物质,甲:2mol SO2 1mol O2乙:2mol SO2 1mol O2 1mol N2 丙:4mol SO2 2mol O2同时进行反应,开始时反应速率最大的是( )
A.甲
B.乙
C.丙
D.无法判断
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究氮、磷等单质及其化合物的反应有重要意义.
(1)试判断用于汽车净化的一个反应2NO(g)+2CO(g)═N2(g)+2CO2(g),在298K、100kPa下能否自发进行(填“能”或“否”).已知:在298K、100kPa下该反应的△H=﹣113.0kJmol﹣1 , △S=﹣145.3Jmol﹣1K﹣1 .
(2)25℃下,将a molL﹣1的氨水与0.005molL﹣1的硫酸等体积混合,反应平衡时溶液中c(NH4+)=2c(SO42﹣),用含a的代数式表示NH3H2O的电离常数Kb= .
(3)25℃时,Ksp(BaSO4)=1.1×10﹣10 , Ksp(BaCO3)=2.6×10﹣9 , 现将BaCl2溶液滴入浓度均为0.01molL﹣1的Na2SO4和Na2CO3的混合溶液中,当两种沉淀共存时,溶液中c (CO32﹣):c(SO42﹣)=(不考虑CO32﹣的水解)
(4)次磷酸(H3PO2)是一种一元中强酸,重要的精细化工产品.
①写出次磷酸的电离方程式: .
②已知某温度下0.01mol/L的NaOH溶液pH=10,将该NaOH溶液与等浓度等体积的H3PO2溶液混合,混合后溶液pH=7,则此时c(OH﹣)﹣c(H3PO2)= . 该温度下将pH=a的盐酸Vaml与pH=b的氢氧化钠Vbml混合后溶液呈中性,且a+b=10,则Va:Vb= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑
(1)氧化剂与还原剂的物质的量之比是_________,HCl在反应中表现的性质有____________。
(2)单线桥标明该反应电子转移方向和数目:________________________。
(3)写出以软锰矿为原料制备Cl2的化学方程式___________________。
Ⅱ.(1)VLFe2(SO4)3溶液中含Fe3+ag,则该溶液中溶质的物质的量浓度为______________。
(2)为了供学生课外活动,要求把SO42-、CO32-、H+、OH-、NH4+、Fe3+、Na+七种离子根据共存原理分为两组混合溶液,分配结果是:
第一组:_______________;第二组:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 丙酮是一种常用的有机溶剂,可与水以任意体积比互溶,密度小于1 g/mL,沸点约55 ℃,分离水和丙酮时最合理的方法是( )
A.蒸发B.蒸馏C.过滤D.分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:请回答: 
三个反应的平衡常数分别为K1、K2和K3推断反应③为△H30(填“>”成“<”)根据反应①和反应②可推导出K1、K2和K3的关系式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液。实验操作过程如下:
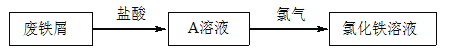

根据要求回答问题:
(1)用浓盐酸配制250mL 0.2molL-1稀盐酸,右图是某同学转移溶液的示意图,写出仪器 A的名称: 。
(2)图中有两处错误分别是 , 。
(3)废铁屑用盐酸处理后,还含有不溶性杂质,为获取澄清的A溶液,进行物质分离的操作名称是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( ) 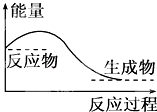
A.任何化学反应都伴随着能量的变化
B.H2O(g)═H2O(l)该过程放出大量的热,所以该过程是化学变化
C.化学反应中能量的变化都表现为热量的变化
D.对于如图所示的过程,是吸收能量的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将amol小苏打和bmol过氧化钠置于某体积可变的密闭容器中充分加热,反应后测得容器内的氧气为1mol,下列说法一定正确的是( )
A.b=2
B.容器中一定没有残余的CO2和水蒸气
C.a:b≥1
D.反应中转移的电子数一定为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com