
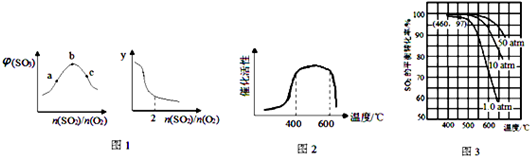
分析 (1)当二氧化硫的量与氧气的物质的量之比等于系数之比时三氧化硫的体积分数最大;图2表示随着二氧化硫量的增加而逐渐减小的量;
(2)根据lgKp=$\frac{4905.5}{T}$-4.6455知,升高温度平衡常数减小,说明平衡逆向移动;
(3)①将方程式2(①+②)得2SO2(g)+O2(g)?2SO3(g),据此计算化学平衡常数;
②催化剂通过降低反应的活化能,活化分子百分数增大,有效碰撞几率提高,从而增大反应速率;
(4)混合气体中7.0% SO2、11% O2、82% N2,假设有混合气体100mol,则二氧化硫为7mol、氧气11mol、氮气82mol,460℃、1.0atm下二氧化硫转化率为97%,则参加反应的n(SO2)=7mol×97%=6.79mol,
剩余的n(SO2)=7mol×3%=0.21mol,
剩余的n(O2)=11mol-$\frac{1}{2}$×6.79mol=7.605mol,生成的三氧化硫物质的量=6.79mol,反应后混合气体总物质的量=0.21mol+7.605mol+6.79mol+82mol=96.605mol,
反应前后物质的量之比等于其压强之比,
则反应后压强=$\frac{0.21mol+7.605mol+6.79mol+82mol}{100mol}$×1atm=0.9579atm,
二氧化硫的分压=$\frac{0.21mol}{96.605mol}$×0.9579atm,
氧气分压=$\frac{7.605mol}{96.605mol}$×0.9579atm,
三氧化硫分压=$\frac{6.79mol}{96.605mol}$×0.9579atm,
化学平衡常数Kp=$\frac{p(SO{\;}_{3})}{P(SO{\;}_{2})×\sqrt{P(O{\;}_{2})}}$;
(5)根据工业生产既要考虑转化率又要考虑反应速率还要考虑对设备的要求等,据此分析.
解答 解:(1)当二氧化硫的量与氧气的物质的量之比等于系数之比时三氧化硫的体积分数最大,b点三氧化硫体积分数最大,此点处n(SO2)/n(O2)=2:1;
由图象可知,n(SO2)/n(O2)越大,y值越小,
A.平衡常数仅与温度有关,所以n(SO2)/n(O2)变化,平衡常数不变,不符合图象,故错误;
B.n(SO2)/n(O2)越大,二氧化硫物质的量越大,则SO3的平衡产率越大,不符合图象,故错误;
C.n(SO2)/n(O2)越大,二氧化硫物质的量越大,则O2的转化率越大,不符合图象,故错误;
D.n(SO2)/n(O2)越大,二氧化硫物质的量越大,则SO2的平衡转化率越小,符合图象,故正确;
故答案为:2;D;
(2)根据lgKp=$\frac{4905.5}{T}$-4.6455知,升高温度平衡常数减小,说明平衡逆向移动,正反应是放热反应,焓变小于0,
故答案为:<0;
(3)①将方程式2(①+②)得2SO2(g)+O2(g)?2SO3(g),方程式相加平衡常数相乘,方程式扩大2倍,平衡常数变为原来的平方,所以该反应化学平衡常数K等于(K1×K2)2,故答案为:(K1×K2)2;
②催化剂通过降低反应的活化能,活化分子百分数增大,有效碰撞几率提高,从而增大反应速率,故答案为:降低反应的活化能,活化分子百分数增大,有效碰撞几率提高;
(4)混合气体中7.0% SO2、11% O2、82% N2,假设有混合气体100mol,则二氧化硫为7mol、氧气11mol、氮气82mol,460℃、1.0atm下二氧化硫转化率为97%,则参加反应的n(SO2)=7mol×97%=6.79mol,
剩余的n(SO2)=7mol×3%=0.21mol,
剩余的n(O2)=11mol-$\frac{1}{2}$×6.79mol=7.605mol,生成的三氧化硫物质的量=6.79mol,反应后混合气体总物质的量=0.21mol+7.605mol+6.79mol+82mol=96.605mol,
反应前后物质的量之比等于其压强之比,
则反应后压强=$\frac{0.21mol+7.605mol+6.79mol+82mol}{100mol}$×1atm=0.9579atm,
二氧化硫的分压=$\frac{0.21mol}{96.605mol}$×0.9579atm,
氧气分压=$\frac{7.605mol}{96.605mol}$×0.9579atm,
三氧化硫分压=$\frac{6.79mol}{96.605mol}$×0.9579atm,
化学平衡常数Kp=$\frac{p(SO{\;}_{3})}{P(SO{\;}_{2})×\sqrt{P(O{\;}_{2})}}$=$\frac{\frac{6.79mol}{96.605mol}×0.9579atm}{\frac{0.21mol}{96.605mol}×0.9579atm×\sqrt{\frac{7.605mol}{96.605mol}×0.9579atm}}$=113atm1/2,
故答案为:113atm1/2;
(5)根据图知,在400~500℃时二氧化硫转化率较大,反应速率快,所以工业生产最适宜的温度范围为400~500℃,又常压下SO2的平衡转化率已经很大,再增大压强,对设备要求较高,故答案为:400~500℃; 常压下SO2的平衡转化率已经很大,再增大压强,对设备要求较高.
点评 本题考查化学平衡计算、图象分析,为高频考点,侧重考查学生分析推断及计算、知识迁移能力,根据浓度化学平衡常数计算方法计算压强化学平衡常数,计算量较大,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 氮元素及其化合物在生产、生活中有着广泛的应用.
氮元素及其化合物在生产、生活中有着广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CH3COOH 溶液做导电性实验,灯泡很暗,能证明 CH3COOH 是弱电解质 | |
| B. | 将Ca(OH)2的饱和溶液加热,pH 和 Kw均增大 | |
| C. | 25℃时,1.0×10-3mol•L-1盐酸的pH=3.0,1.0×10-8 mol•L-1盐酸的pH=8.0 | |
| D. | 向pH相同的氨水和氢氧化钠溶液中分别加入适量NH4Cl(s)后,两溶液的pH均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的 刻度(mL) | ||
| 第①次 | 10.00 | 0.40 | 20.50 |
| 第②次 | 10.00 | 4.10 | 24.00 |
| 第③次 | 10.00 | 2.20 | 23.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P2O5可用于干燥Cl2和NH3 | |
| B. | NO2溶于水时发生氧化还原反应 | |
| C. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 | |
| D. | 液氨汽化时要吸收大量的热,可用作制冷剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com