
 乙酰苯胺,白色由光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂,退热剂.防腐剂和染料中间体,制备原理如下:
乙酰苯胺,白色由光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂,退热剂.防腐剂和染料中间体,制备原理如下:
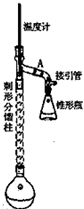
分析 (1)刺形分馏柱起冷凝回流作用;
(2)Zn与醋酸反应生成醋酸锌与氢气;苯胺不稳定,容易被空气中的氧气氧化为硝基苯,利用反应生成氢气排尽装置内的空气;
(3)操作中利用热水溶解粗产品,再冷却析出乙酰苯胺晶体,应是利用重结晶方法;
(4)本实验中利用刺形分馏柱进行冷凝回流,充分利用原料;用小火加热回流,保持温度在105℃,水的沸点是100℃,锥形瓶中收集的馏分主要为水,目的是将反应生成的水与反应体系分离,有利于反应正向进行;
(6)计算苯胺、乙酸的物质的量,判断反应物过量问题,根据不足量的物质计算乙酰苯胺的理论产量,进而计算乙酰苯胺的产率.
解答 解:(1)有机物易挥发性,刺形分馏柱起冷凝回流作用,
故答案为:冷凝回流;
(2)Zn与醋酸反应生成醋酸锌与氢气,反应方程式为:Zn+CH3COOH=Zn(CH3COO)2+H2↑;苯胺不稳定,容易被空气中的氧气氧化为硝基苯,利用反应生成氢气排尽装置内的空气,防止苯胺在反应过程中被氧化;
故答案为:Zn+CH3COOH=Zn(CH3COO)2+H2↑;排尽装置内的空气,防止苯胺在反应过程中被氧化;
(3)操作中利用热水溶解粗产品,再冷却析出乙酰苯胺晶体,应是利用重结晶方法,故选:C;
(4)本实验中利用刺形分馏柱对反应物冷凝回流,充分利用原料;用小火加热回流,保持温度在105℃,水的沸点是100℃,锥形瓶中收集的馏分主要为水,目的是将反应生成的水与反应体系分离,有利于反应正向进行,均有利于提高原料的利用率,
故答案为:反应物冷凝回流;蒸发出水;
(5)n(苯胺)=(10mL×1.0217g/mL)÷93g/mol=0.1099mol,n(乙酸)=( 15mL×1.05g/ml)÷60g/mol=0.2625mol,Zn反应的醋酸为$\frac{0.2g}{65g/mol}$×2=0.0062,实际进入醋酸为0.2563mol,二者按1:1反应,由于乙酸的物质的量大于苯胺的物质的量,所以产生乙酰苯胺的物质的量要以不足量的苯胺为原料为标准,乙酰苯胺的理论产量为0.1mol,而实际产量n(乙酰苯胺)=12.58g÷135g/mol,所以乙酰苯胺的产率为[(12.58g÷135g/mol)÷0.1099mol]×100%≈85%,
故答案为:85%.
点评 本题考查有机物的合成实验、基本操作、实验条件的控制与分析评价等,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | r(S2-)>r(O2-)>r(F-) | B. | r(Al)>r(Mg)>r(Na) | C. | r(Na+)>r(O2-)>r(F-) | D. | r(Na)>r(Na+)>r(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ | |
| C. | 反应达平衡时,若升高温度,则硅的产量会提高 | |
| D. | 当反应吸收热量为0.025QkJ时,生成的HCl通入200mL 1mol•L-1的NaOH恰好反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
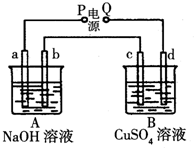 按如图装置实验,A、B两烧杯分别盛放200g 10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).a、b、c为石墨电极,d为铜电极.
按如图装置实验,A、B两烧杯分别盛放200g 10%NaOH和足量CuSO4溶液.通电一段时间后,c极上有Cu析出;又测得A杯中溶液的质量减少4.5g(不考虑水的蒸发).a、b、c为石墨电极,d为铜电极.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各物质的浓度之比为1:3:3 | |
| B. | 混合物各物质的浓度相等 | |
| C. | ν(A)、ν(B)、ν(C) 之比为1:3:3 | |
| D. | A、B、C三种物质的浓度不随时间变化而变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com