
【题目】Ⅰ.研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
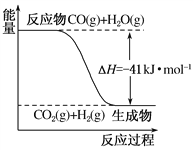
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:该反应的热化学方程式为
________________________________
(2)已知:C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131 kJ·mol-1,则C(s)+CO2(g)===2CO(g) ΔH=________。
(3)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391.55 kJ·mol-1。则1/2N2(g)+3/2H2(g)===NH3(g) ΔH=________。
Ⅱ.下图是一个化学过程的示意图,回答下列问题:
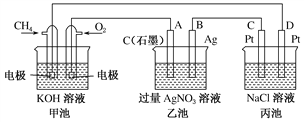
(1)甲池是________装置,乙装置中电极A的名称是____。
(2)甲装置中通入CH4的电极反应式为_______________________,乙装置中电极B(Ag)的电极反应式为_______________________
(3)一段时间,当丙池中产生112 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25 ℃时的pH=________。(已知:NaCl溶液足量,电解后溶液体积为500 mL)。若要使丙池恢复电解前的状态,应向丙池中通入________(写化学式)。
【答案】 CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·mol-1 +172 kJ·mol-1 -46.2 kJ·mol-1 原电池 阳极 CH4+10OH--8e-===CO![]() +7H2O Ag++e-===Ag 12 HCl
+7H2O Ag++e-===Ag 12 HCl
【解析】Ⅰ.(1)图象分析反应是放热反应,焓变为-41KJ/mol,标注物质狙击状态和对应反应焓变得到热化学方程式为:CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJmol-1,故答案为:CO(g)+H2O(g)═CO2(g)+H2(g) △H=-41kJmol-1;
(2)①CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41kJmol-1;②C(s)+H2O(g)═CO(g)+H2(g) △H=+131kJmol-1,依据盖斯定律②-①得到:C(s)+CO2(g)═2CO(g)△H═+172kJ/mol,故答案为:+172kJ/mol;
(3)N≡N键的键能是948.9kJmol-1,H-H键的键能是436.0kJmol-1;N-H键的键能是391.55kJmol-1.则![]() N2(g)+
N2(g)+ ![]() H2(g)═NH3(g);△H=反应物键能总和-生成物键能总和=
H2(g)═NH3(g);△H=反应物键能总和-生成物键能总和=![]() ×948.9kJmol-1 +
×948.9kJmol-1 +![]() ×436.0kJmol-1 -3×391.55kJmol-1=-46.2kJ/mol,故答案为:-46.2kJ/moL;
×436.0kJmol-1 -3×391.55kJmol-1=-46.2kJ/mol,故答案为:-46.2kJ/moL;
Ⅱ.(1)甲池中一极通入甲烷,另一极通入氧气,所以甲池为甲烷形成的燃料电池,通入甲烷的一极为负极,通入氧气的一极为正极,A与正极相连,所以A为阳极;故答案为:原电池;阳极;
(2)CH4在负极上失电子,碱性条件下生成碳酸根,所以甲装置中通入CH4的电极反应式为CH4+10OH--8e-=CO32-+7H2O;乙装置中B(Ag)的电极为银离子得电子,其电极反应式为:Ag++e-=Ag;故答案为:CH4+10OH--8e-=CO32-+7H2O;Ag++e-=Ag;
(3)设电解后氢氧化钠的物质的量浓度是xmol/L,丙池中产生112mL,则氢气的体积与氯气的体积相同均为56mL,
2NaCl+2H2O![]() H2↑+Cl2↑+2NaOH,
H2↑+Cl2↑+2NaOH,
22.4L 2mol
0.056L 0.5xmol
则x=![]() =0.01mol/L,则c(H+)=10-12 mol/L,所以溶液的pH=12,由于电解生成H2和Cl2从溶液中逸出,所以应该加二者的化合物,即加入HCl,故答案为:12;HCl。
=0.01mol/L,则c(H+)=10-12 mol/L,所以溶液的pH=12,由于电解生成H2和Cl2从溶液中逸出,所以应该加二者的化合物,即加入HCl,故答案为:12;HCl。


 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】LiOH和钴氧化物可用于制备锂离子电池正极材料。利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。下列说法不正确的是( )

A. B极区电解液为LiOH溶液
B. 电解过程中Li+向B电极迁移
C. 每产生标准状况下2.24L氢气,就有0.1mol阳离子通过交换膜进入阴极区
D. 阳极电极反应式为2Cl- - 2e-=Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝箔在酒精灯上加热至熔化的实验现象与下列性质的叙述无关的是( )
A. 铝表面可形成一层氧化物保护膜
B. 铝的熔点较低
C. Al2O3熔点高,酒精灯不能将其熔化
D. 铝能与酸或强碱溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有盐酸和氯化钙的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如右图所示,则X是( )
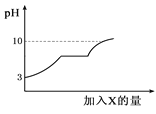
A. 浓硫酸 B. 澄清石灰水
C. 烧碱溶液 D. 纯碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将 2molSO2 和 1molO2 通入体积为 2L 的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) ,△H=-196.6kJ/mol. 2min 时反应达到化学平衡,此时测得反应物O2 还剩余 0.8mol,请填写下列空白:
2SO3(g) ,△H=-196.6kJ/mol. 2min 时反应达到化学平衡,此时测得反应物O2 还剩余 0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成 SO3 的平均反应速率为__________ ;平衡时,SO2 转化率为_____________
(2)下列叙述能证明该反应已达到化学平衡状态的是 __________
A.容器内压强不再发生变化 B.SO2 的体积分数不再发生变化
C.容器内气体原子总数不再发生变化 D.相同时间内消耗 2nmolSO2 的同时消耗 nmolO2
E.相同时间内消耗 2nmolSO2 的同时生成 nmolO2 F.混合气体密度不再变化
(3)以下操作会引起化学反应速率变快的是__________
A.向容器中通入O2 B.扩大容器的体积 C.使用正催化剂
D.升高温度 E.向容器中通入氦气。
(4)t2℃时,若将物质的量之比 n(SO2) :n(O2)=1:1 的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了 20%。则SO2 的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】向硫酸铜水溶液中逐滴加入氨水,先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,再向溶液中加入乙醇有深蓝色晶体(化学式为[Cu(NH3)4]SO4·H2O)析出。
(1)写出上述实验前两步反应的离子方程式 , 。
(2)铜元素基态原子的电子排布式为 ,铜单质晶体中的原子堆积模型属于 堆积(填堆积模型名称)。
(3)在上述深蓝色晶体所含的非金属元素中,电负性最大的是 (填元素符号),第一电离能最大的是 (填元素符号)。该晶体中的阴离子的立体构型是 ,阴离子的中心原子的杂化方式为 。
(4)氨的沸点 (填“高于”或“低于”)膦(PH3),原因是 。

(5)Cu的一种氯化物晶胞结构如图所示,该氯化物的化学式是 。若该晶体的密度为ρg·cm-3,以NA表示阿伏加德罗常数,则该晶胞的边长为a= nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种固体物质溶解度曲线如图所示。请回答:
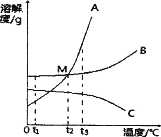
(1)图中M点表示_________________;
(2)t3℃时A、B、C三种物质的溶解度由小到大的顺序是____________;
(3)现有t1℃时A、B、C的三种饱和溶液,分别将它们升温到t3℃,溶质的质量分数由大到小的顺序是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应2KClO3+I2=2KIO3+Cl2↑判断,下列结论不正确的是( )
A.I2具有还原性
B.该反应属于置换反应
C.氧化剂是KClO3
D.当生成1mol Cl2时,转移2mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com