
(14分)氧化锌是橡胶、油漆、搪瓷、电缆、医药、电子、化学等工业的重要原料。以氧
化锌粗品为原料制备活性氧化锌的生产工艺流程如下: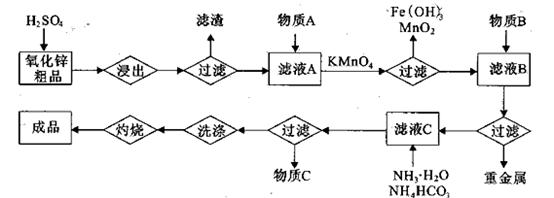
(1).浸出”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+、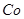 +、Mn2+等
+、Mn2+等
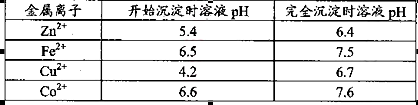
杂质。物质A的作用是调节溶液的pH至5 4,物质A最好选择________。
| A.NH3.H2O | B.Na2CO3 | C.H2SO4 | D.ZnO |
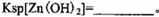 。
。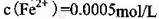 ,则处理1
,则处理1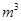 该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。
该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。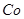 2+可利用置换反应除去,则物质B是_________。
2+可利用置换反应除去,则物质B是_________。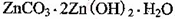 ,生成该沉淀的化学方程式为________。
,生成该沉淀的化学方程式为________。(每空2分,共14分)
(1) D ; 1.0×10-20.2
(2)2MnO4―+3Mn2+ + 2H2O = MnO2+ 4H+ ; 26.33
(3)锌粉
(4)3ZnSO4 + 5NH3·H2O + NH4HCO3 = ZnCO3·2Zn(OH)2·H2O↓ + 3 (NH4)2SO4;
向最后一次的洗涤液中滴入1~2滴BaCl2溶液,若无明显的现象,则沉淀已洗净。
解析试题分析:(1)该流程的目的是制备氧化锌,所以为了不引入新的杂质,需要选择氧化锌 调节溶液的pH值,答案选D;Zn(OH)2完全沉淀时c(Zn2+)=1×10-5mol/L,c(OH-)=1×10-14/1×10-6.4=1×10-7.6mol/L,所以该温度下Zn(OH)2的Ksp= c(OH-)2×c(Zn2+)=1.0×10-20.2
(2)根据流程图可知,加入高锰酸钾后有二氧化锰沉淀出现,所以KMnO4与Mn2+反应生成二氧化锰,离子方程式为2MnO4―+3Mn2+ + 2H2O = MnO2+ 4H+ ;根据得失电子守恒规律,存在MnO4-~3Fe2+,1m3的该溶液中n(Fe2+)=0.5mol,则需要KMnO4的质量为0.5mol/3×158g/mol=26.33g;
(3)杂质Cu2+、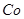 2+可利用置换反应除去,同样是为了不能引入新的杂质,B应是锌粉;
2+可利用置换反应除去,同样是为了不能引入新的杂质,B应是锌粉;
(4)生成ZnCO3·2Zn(OH)2·H2O应是在加入碳酸氢铵与氨水后产生的,溶液中的硫酸锌与之反应生成的沉淀,所以化学方程式为3ZnSO4 + 5NH3·H2O + NH4HCO3 = ZnCO3·2Zn(OH)2·H2O↓ + 3 (NH4)2SO4; 该沉淀中还可能含有硫酸根离子,所以检验洗涤是否干净的方法就是检验硫酸根离子是否存在,具体操作为向最后一次的洗涤液中滴入1~2滴BaCl2溶液,若无明显的现象,则沉淀已洗净。
考点:考查对流程的分析,溶度积的计算,化学方程式、离子方程式的判断与书写,氧化还原反应的计算,洗涤操作的判断


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
下列离子或分子在溶液中能大量共存,但通入NO2后不能大量共存,且不会生成沉淀的一组是( )
| A.K+、Na+、NO3-、SiO32- | B.Al3+、K+、SO42-、S2- |
| C.Ag+、Na+、NH3·H2O、NO3- | D.Cu2+、Fe2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(18分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能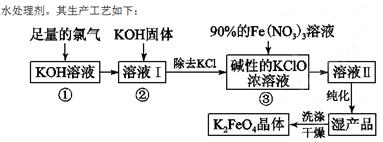
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH与Cl2反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式 ,该反应的氧化产物是 。
(2)在溶液Ⅰ中加入KOH固体的目的是 (填编号)。
| A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供碱性的环境 |
| D.使KClO3转化为KClO |
 +____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
+____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯和综合应用工艺如下:
(注:SiCl4的沸点是57.6ºC,金属氯化物的沸点均高于150ºC)
(1)向反应器中通入Cl2前,需通一段时间的N2,主要目的是 。
(2)高温反应后,石墨中的氧化物杂质均转变为相应的氯化物。气体I中的氯化物主要为 。由气体II中某物质得到水玻璃的化学方程式为 。
(3)步骤①为:搅拌、 。所得溶液IV中阴离子有 。
(4)由溶液IV生成沉淀V的总反应的离子方程式为 。100kg初级石墨最多可获得V的质量为kg 。
(5)石墨可用于自然水体中铜件的电化学防腐,完成下图防腐示意图,并作相应标注。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
炼金废水中含有络离子[Au(CN)2]+,其电离出的CN—有毒,CN-与H+结合生成HCN时,其毒性更强。回答下列问题:
(1)HCN的电离方程式为______________________NaCN溶液的pH_____7(填“< > =”)
(2)与弱电解质的电离方程式相似,[Au(CN)2]+也存在着两步电离,其一级电离方程式为_________
(3)处理这种废水是在碱性条件下,NaClO将CN—氧化为碳酸根和氮气,其离子方程式为:__________
(4)在酸性条件下,ClO—也能氧化CN--,但实际处理废水时却不在酸性条件下进行的原因是_______________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

提示:在本实脸条件下,Ni(Ⅱ)不能被氧化:高锰酸钾的还原产物是MnO2
回答下列问题:
(1)反应②中除掉的杂质离子是 ,发生反应的离子方程式为 ;在加高锰酸钾溶液前,若pH较低,对除杂的影响是 。
(2)反应③的反应类型为 ,过滤得到的滤渣中,除了过量的锌外还有 。
(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是 。
(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2取干操后的滤饼11.2g,煅烧后可得到产品8.1g,则x等于 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)二氧化钛广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:TiCl4水解生成TiO2·xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2,此方法制备得到的是纳米二氧化钛。
(1)①TiCl4水解生成TiO2·xH2O的化学方程式为 。
②检验TiO2·xH2O中Cl-是否被除净的方法是 。
方法2:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下: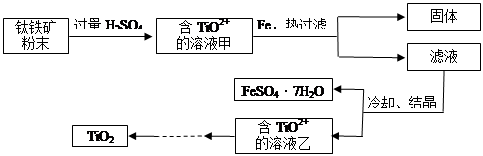
(2)Fe2O3与H2SO4反应的离子方程式是 。
(3)甲溶液中除含TiO2+之外还含有的金属阳离子有 。
(4)加Fe的作用是 。
Ⅱ、二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及到的步骤如下:
TiO2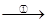 TiCl4
TiCl4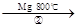 Ti
Ti
反应②的方程式是 ,该反应需要在Ar气氛中进
行,请解释原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有关FeSO4的转化关系如图所示(部分物质已略去)。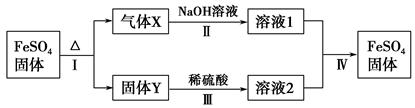
已知:①X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,产生白色沉淀。
②Y是红棕色的化合物。
(1)气体X的成分是(填化学式) 。
(2)反应Ⅰ的反应类型属于(填序号) 。
a.分解反应 b.复分解反应
c.置换反应 d.化合反应
e.氧化还原反应
(3)溶液2中金属阳离子的检验方法是 。
(4)若经反应Ⅰ得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol·L-1 NaOH溶液完全吸收,则反应Ⅳ中生成FeSO4的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH4+、Mg2+、Ba2+、Cl-、NO2-、SO42-、CO32-。将该混合物溶于水后得澄清溶液,现取4份100 mL该溶液分别进行如下实验:
| 实验 序号 | 实验内容 | 实验结果 |
| A | 加AgNO3溶液 | 有白色沉淀生成 |
| B | 加足量NaOH溶液并加热 | 收集到气体1.12 L(已折算成标准状况下的体积) |
| C | 加足量BaCl2溶液,对所得沉淀进行洗涤、干燥、称量;再向沉淀中加足量稀盐酸,然后干燥、称量 | 第一次称量沉淀质量为6.27 g,第二次称量沉淀质量为2.33 g |
| D | 加少量KMnO4酸性溶液 | KMnO4溶液褪色 |
| 阴离子符号 | 物质的量浓度(mol·L-1) |
| | |
| | |
| | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com