
 水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是( )
水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是( )| A. | 改变条件使纯水的pH值减小,其酸性增强 | |
| B. | 100℃时某溶液中由水电离产生的c(H+)=1×10-11 mol•L-1,则该溶液的pH可能是11或3 | |
| C. | 将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10:1 | |
| D. | 100℃时,pH值均为8的醋酸钠和氨水两溶液中,水的电离程度之比为104:1 |
分析 A、纯水中,c(H+)=c(OH-),仍然呈中性;
B、100℃时水的离子积为10-12,根据由水电离产生的c(H+)═1×10-11mol•L-1,溶液可能为酸性或碱性溶液计算出溶液中氢离子浓度;
C、100℃混合溶液的pH=7,该溶液为碱性溶液,设出两溶液的体积,列式计算出二者体积之比;
D、含有弱根离子的盐能促进水的电离,酸或碱能抑制水的电离,据此解答即可.
解答 解:A、纯水中,c(H+)=c(OH-),仍然呈中性,故A错误;
B、100℃时水的离子积为10-12,由水电离产生的c(H+)=1×10-11mol•L-1,若溶液为酸性溶液,氢离子浓度为:0.1mol/L,溶液的pH=1;若为碱性溶液,则溶液中氢离子浓度为1×10-11mol•L-1,溶液pH=11,故B错误;
C、100℃时水的离子积为10-12,混合溶液的pH=7,溶液中氢离子浓度为1×10-7mol•L-1,氢氧根离子浓度为1×10-5mol•L-1,反应后的溶液为碱性溶液;pH=9的Ba(OH)2溶液中氢氧根离子浓度为1×10-3mol•L-1,与pH=4的稀盐中氢离子浓度为1×10-4mol•L-1,设氢氧化钡的体积为x,盐酸溶液的晶体为y,则:$\frac{1{0}^{-3}x-1{0}^{-4}y}{x+y}$=1×10-5,解得x:y=1:10,故C错误;
D、pH=8的醋酸钠溶液氢氧根离子来源于水的电离,即水电离出的氢氧根离子浓度为$\frac{1{0}^{-12}}{1{0}^{-8}}$=10-4,pH=8的氨水氢离子来源于水的电离,即水电离出的氢离子浓度为10-8,故水的电离程度之比为104:1,故D正确;
故选D.
点评 本题考查了水的电离、酸碱中和反应、溶液pH的简单计算等知识,题目难度中等,试题涉及的知识点较多,充分考查了学生对学生学生的掌握情况,培养了学生灵活应用所学知识的能力.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:解答题
 碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:
碳、氮及其化合物在工农业生产生活中有着重要作用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
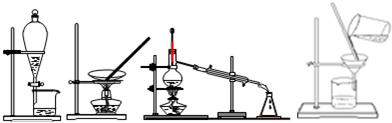
| A. | 过滤、蒸发、蒸馏、萃取 | B. | 过滤、蒸馏、蒸发、萃取 | ||
| C. | 蒸发、蒸馏、过滤、萃取 | D. | 萃取、蒸发、蒸馏、过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com