
| A. | 通HCl(g) | B. | 加入少量KF(s) | C. | 加入少NaOH(s) | D. | 通入少量HF(g) |
分析 可以使c(HF)/c(H+)减小,可使平衡正向移动,且不能加HF使平衡正向移动,或加含氢离子的物质使平衡逆向移动,以此来解答.
解答 解:A.通HCl(g),平衡逆向移动,c(H+)增大,且c(H+)增大的程度大于c(HF)增大的程度,则c(HF)/c(H+)减小,故A选;
B.加入少量KF(s)平衡逆向移动,c(H+)减小,c(HF)/c(H+)增大,故B不选;
C.加入少NaOH(s),c(H+)减小,平衡正向移动,且c(H+)减小的程度大于c(HF)减小的程度,则c(HF)/c(H+)增大,故C不选;
D.通入少量HF(g),平衡正向移动,且c(HF)增大的程度大于c(H+)增大的程度,则c(HF)/c(H+)增大,故D不选;
故选A.
点评 本题考查弱电解质的电离平衡,为高频考点,把握平衡移动、离子浓度的变化为解答的关键,侧重分析与应用能力的考查,注意平衡移动原理的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
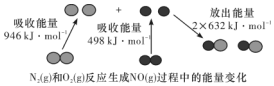 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )| A. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ | |
| B. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| C. | 在1 L的容器中发生反应,10 min内 N2 减少了1 mol,因此10 min内的平均反应速率为v(NO)=0.1 mol/(L•min) | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
| △H/(kJ/mol) | -283.0 | -285.8 | -726.5 | -890.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
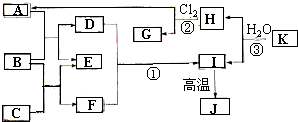 图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出).
图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液呈浅绿色 | |
| B. | 该溶液中加入NaOH溶液,生成白色沉淀 | |
| C. | 向该溶液中加入氯水,再滴入几滴KSCN溶液,呈红色 | |
| D. | 向该溶液中滴入几滴KSCN溶液,不变色,再加入氯水,呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 符合的条件 | 序号 |
| 1 | 电解质 | |
| 2 | 非电解质 | |
| 3 | 强电解质 | |
| 4 | 弱电解质 | |
| 5 | 既不是电解质也不非电解质 | |
| 6 | 能导电的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由 Al、Cu、稀 H2SO4 组成原电池,放电时 SO42-向 Al 电极移动 | |
| B. | 由 Mg、Al、NaOH 溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O | |
| C. | 由 Al、Cu、浓硝酸组成原电池作电源,用石墨电极来电解硝酸银溶液,当析出 1 mol Ag时,消耗铜电极32 g | |
| D. | 由 Fe、Cu、FeCl3 溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com