
【题目】(1)O2和O3是氧元素的两种单质。根据分子式回答。等质量的O2和O3的物质的量之比为____,原子个数比为_____。
(2)NO2和N2O4是氮元素的两种常见氧化物,常温下都是气体,它们之间在常温下就能相互转化,因而经常见到的是两种气体的混合物。现取46g该气体,所含氮原子的物质的量为_____。
(3)已知三种物质NaCl、MgCl2、AlCl3分别溶于水,若溶液中的钠、镁、铝三种元素的质量比为23︰16︰9。则:
①NaCl、MgCl2、AlCl3三种物质的物质的量之比为_____;
②其中所含Cl-物质的量之比为_____。
【答案】3︰2 1︰1 1mol 3︰2︰1 3︰4︰3
【解析】
(1)设O2和O3的质量都是mg,等质量的O2和O3的物质的量分别是![]() 、
、![]() 。
。
(2)NO2和N2O4的最简式都是NO2,可以把46g混合气体看做全是NO2。
(3)NaCl、MgCl2、AlCl3分别溶于水,溶液中的钠、镁、铝三种元素的质量比为23︰16︰9,设含钠、镁、铝的质量分别是23g、16g、9g,钠、镁、铝的物质的量分别是![]() 、
、![]() 、
、![]() 。
。
(1)等质量的O2和O3的物质的量之比=![]() :
:![]() =3:2,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以其氧原子个数=(
=3:2,一个氧气分子中含有2个氧原子,一个臭氧分子中含有3个氧原子,所以其氧原子个数=(![]() ):(
):(![]() )=1:1;
)=1:1;
(2)NO2和N2O4的最简式相同,最简式为NO2,46g气体混合物可看作是46gNO2,46gNO2的物质的量为![]() ,1个NO2中含有1个N原子,所含氮原子的物质的量为1mol;
,1个NO2中含有1个N原子,所含氮原子的物质的量为1mol;
(3)①根据元素守恒,NaCl、MgCl2、AlCl3三种物质的的物质的量比=钠、镁、铝三种元素的物质的量比=1:![]() :
:![]() =3:2:1;
=3:2:1;
②所含氯离子物质的量的比=3×1:2×2:1×3=3:4:3。


科目:高中化学 来源: 题型:
【题目】配平下列反应的化学方程式,标出电子转移方向和数目,并回答有关问题:
Na2Cr2O7+KI+HCl →CrCl3 +NaCl +KCl+I2 + __________ __________。
(1)上面反应中氧化剂是____,被氧化的元素是___。
(2)HCl的作用___。
(3)若反应过程中有0.50molI2被氧化出来,且有__mol电子发生了转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,在两个容积相同的容器中,一个盛有CO气体,另一个盛有CO2气体,则两容器内的气体一定具有相同的
A.密度 B.原子数 C.质量 D.分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
t / s | 0 | 50 | 150 | 250 | 350 |
n(PCl3) / mol | 0 | 0. 16 | 0. 19 | 0. 20 | 0. 20 |
A. 体系平衡时与反应起始时的压强之比为5∶6
B. 反应在前50 s 的平均速率ν(PCl3)= 0. 0032 mol·L-1·s-1
C. 相同温度下,起始时向容器中充入0.6mol PCl5、0. 20 mol PCl3 和0. 20 mol Cl2,反应达到平衡前ν(正)>ν(逆)
D. 相同温度下,若起始时向容器中充入2. 0 mol PCl3 和2. 0 mol Cl2,达到平衡时,PCl3 的质量分数比上述平衡体系小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M(NO3)2热分解化学方程式为2M(NO3)2![]() 2MO+4NO2↑+ O2↑,加热29.6 g M(NO3)2使其完全分解,在标准状况下收集11.2 L的气体,那么M的摩尔质量是
2MO+4NO2↑+ O2↑,加热29.6 g M(NO3)2使其完全分解,在标准状况下收集11.2 L的气体,那么M的摩尔质量是
A.24 g·mol-1B.74 g·mol-1
C.148 g·mol-1D.40 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下可以进行如下反应:8H2O +5R2O8n+2Mn2+=2MnO4+10RO42 + 16H+,又知该反应中氧化剂与还原剂的物质的量之比为5:2,则R2O8n中n的值为_____________。
(2)在3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O的反应中,______元素的化合价升高,被氧化;该反应中氧化剂是_______,发生氧化反应的物质是__________;用双线桥法表示反应的电子转移的方向和数目________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生:N2+3H2![]() 2NH3。下列有关说法正确的是( )
2NH3。下列有关说法正确的是( )
A. 达到化学平衡时,正反应和逆反应的速率都为零
B. 当符合:3正N2=正H2时,反应达到平衡状态
C. 达到化学平衡时,单位时间消耗a molN2,同时生成3a molH2
D. 当N2、H2、NH3的分子数比为1∶3∶2,反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)已知室温下CO的燃烧热为283 kJ/mo1,则CO的燃烧热的热化学方程式为___________________________________。
(2)工业上利用CO和H2合成清洁能源CH3OH,其反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH=-116kJ/mo1
CH3OH(g) ΔH=-116kJ/mo1
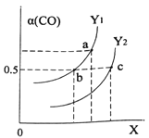
如图表示CO的平衡转化率(α)随温度和压强变化的示意图。X表示的是_____________,Y1_____Y2(填“<”、“=”、“>”)。
(3)合成甲醇的反应原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),在1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。

①反应进行到4min时,v(正)____v(逆)(填“>”“<”或“=”)。0~4min,CO2的平均反应速率v(CO2)=____________mol·L1·min1。
②该温度下平衡常数为_____________。
③下列能说明该反应已达到平衡状态的是______________。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
(4)为提高燃料的能量利用率,常将其设计为燃料电池。某电池以甲烷为燃料,空气为氧化剂,KOH溶液为电解质溶液,以具有催化作用和导电性能的稀土金属为电极。写出该燃料电池的负极反应式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。
该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
2MnO![]() +5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
学习小组的同学设计了如下步骤用滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
(1)上述步骤②中使用的锥形瓶是否需要事先用待测液润洗_______。(填“是”或“否”)滴定时,将酸性KMnO4标准液装在如图中的________(填“甲”或“乙”)滴定管中。

(2)本实验滴定达到终点的标志可以是________________________________。
(3)通过上述数据,求得x=________。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会________(填“偏大”、“偏小”或“不变”,下同)。
②根据上述实验计算的数据可信性不强,为了提高实验的准确性,请写出改进方法______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com