
现有乙酸和两种链状单烯烃(分子中含一个碳碳双键)的混合物,若其中氧的质量分数为a,则碳的质量分数是( )
A.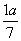 B.
B.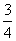 a
a
C.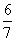 (1-a) D.
(1-a) D.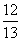 (1-a)
(1-a)
科目:高中化学 来源: 题型:
某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 | K+ | Ag+ | Mg2+ | Cu2+ | Al3+ | NH |
| 阴离子 | Cl- | CO | NO | SO | SiO | I- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.取该无色溶液5 mL,滴加一滴氨水有沉淀生成,且离子种类增加。
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰。
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是______。
( 2)Ⅲ中加入盐酸生成无色气体的离子方程式是________________。
2)Ⅲ中加入盐酸生成无色气体的离子方程式是________________。
(3)甲同学最终确定原溶液中所含阳离子有________,阴离子有________;并据此推测原溶液应该呈________性,原因是________________________(请用离子方程式说明)。
(4)另取100 mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为_____________________________________________________
___________________________________________________________。
充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及 少量杂质铁,利用电解法可回收WC和Co。工艺流程简图如下:
少量杂质铁,利用电解法可回收WC和Co。工艺流程简图如下:
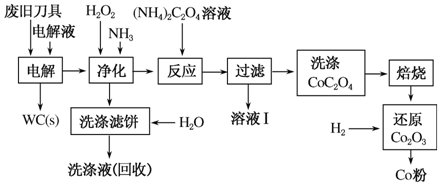
(1)电解时废旧刀具作阳极,不锈钢作阴极,HCl溶液为电解液。阴极主要的电极反应式为________。
(2)净化步骤所得滤饼的主要成分是________。回收的洗涤液代替水配制电解液,目的是回收利用其中的________。
(3)溶液Ⅰ的主要成分是________。洗涤CoC2O4不充分对最终产品纯度并无明显影响,但焙烧时会造成环境污染,原因是______________。
(4)将Co2O3还原成Co粉的化学反应方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列区分植物油和矿物油的方法中,正确的是( )
A.点燃,能燃烧的为矿物油
B.加入水中,浮在水面上的为植物油
C.加入足量的NaOH溶液共煮,不再分层的为植物油
D.尝一尝,能食用的为植物油
查看答案和解析>>
科目:高中化学 来源: 题型:
有一种有机物的结构简式为:
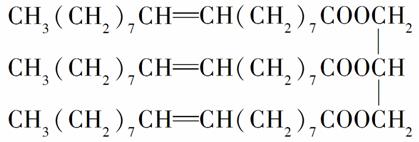
试回答下列问题:
(1)该化合物是________(填选项字母,下同)。
A.烯烃 B.油脂
C.蛋白质 D.糖类
(2)该化合物的密度________。
A.比水大 B.比水小
C.与水相同
(3)常温下该化合物呈________。
A.液态 B.固态
C.气态
(4)下列物质中,能与该物质反应的有________。
A.NaOH(aq) B.溴水
C.乙醇 D.乙酸
E.H2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列是制备CuO的流程图:
工业CuSO4
 CuSO4溶液
CuSO4溶液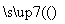 CuSO4·5H2O—→……—→CuO
CuSO4·5H2O—→……—→CuO
(1)步骤Ⅰ的目的是除去不溶性杂质。操作是_________________________________。
(2)步骤Ⅱ的目的是除铁。操作是:滴加H2O2溶液,稍加热;当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制 溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶液pH=3.5的原因是___________________________
溶液pH=3.5;加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1。控制溶液pH=3.5的原因是___________________________
________________________________________________________________________。
(3)步骤Ⅲ的目的是得到CuSO4·5H2O晶体。操作是_____________________________
____________________________________________________________(填操作名称),
过滤,水浴加热烘干。水浴加热的特点是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
利用实验器材(规格和数量不限)能完成相应实验的一项是 ( )
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、蒸发皿 | CuSO4溶液的浓缩结晶 |
| B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去BaSO4中少量的BaCO3 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体NaCl配制 0.5 mol·L-1的溶液 |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中少量的NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主要成分为MnO2,另含有少量头铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去)。
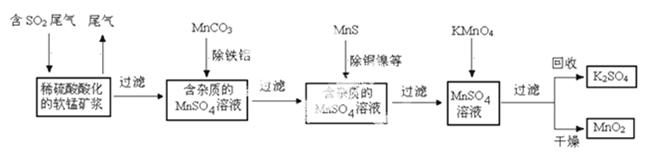
请回答下列 问题:
问题:
(1)上述流程脱硫实现了____(选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)用MnCO3能除去溶液中Al3+和Fe3+,其原因是_____。
(3)已知:25℃、101kpa时,Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol
S(s)+O2(g)=SO2(g) △H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol
SO2与MnO2反应生 成无水MnSO4的热化学方程式是________________。
成无水MnSO4的热化学方程式是________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是
_ _。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是______。
(6)假设脱除的 SO2只与软锰矿浆中的
SO2只与软锰矿浆中的 MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、
MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com