
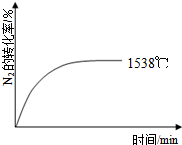
 自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
分析 (1)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO,说明该反应难以进行,反应的活化能高;
(2)①根据图表中的平衡常数随温度变化趋势是,温度越高,K值越大;依据平衡影响因素判断平衡移动;
②氮气的转化率随温度升高达到平衡时间短,转化率高;(3)达到平衡后,要提高N2的转化率,平衡正向进行,依据化学平衡与原理分析选项;
(4)依据热化学方程式和盖斯定律计算得到所需热化学方程式.
解答 解:(1)闪电或者高温,主要是提供能量 给N2分子,让其破坏变成氮原子,因此,只能说明 引发反应所需要的能量高即活化能,不能说明反应吸收的能量高,
故答案为:A;
(2)①在不同温度下,反应N2(g)+O2(g)?2NO(g)的平衡常数K随温度升高K值增大,所以正反应方向是吸热反应,△H>0,故答案为:>;
②1760℃、2404℃时N2的转化率随时间变化的示意图,根据温度越高平衡需要时间越短,氮气转化率越大,画出图象为: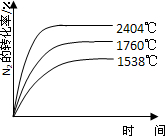 ,
,
故答案为: ;
;
(3)N2(g)+O2(g)?2NO(g),反应是气体体积不变的吸热反应,达到平衡后,要提高N2的转化率,平衡正向进行,依据化学平衡与原理分析选项
A.反应是吸热反应,降低温度,平衡正向进行,氮气转化率增大,故A符合;
B.加催化剂改变反应速率不改变化学平衡,氮气转化率不变,故B不符合;
C.反应前后气体体积不变,增加压强,平衡不动,氮气转化率不变,故C不符合;
D.增加O2浓度平衡正向进行,氮气转化率增大,故D不符合;
E.分离出一氧化氮,平衡正向进行,氮气转化率增大,故E符合;
故答案为:AE;
(4)①N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534kJ/mol
与盖斯定律②×2-①得到肼与NO2反应的热化学方程式:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol;
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol.
点评 本题考查了化学耦合影响因素分析和计算,热化学方程式书写和盖斯定律计算应用,咋给我基础是关键,题目较简单.


科目:高中化学 来源: 题型:多选题
| A. | 饱和碳酸钠溶液中通入过量二氧化碳气体:CO32-+CO2+H2O═2HCO3- | |
| B. | NaHCO3溶液中滴入偏铝酸钠溶液:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- | |
| C. | NaHSO3溶液与FeCl3溶液混合溶液颜色变浅:SO32-+2Fe3++H2O═SO42-+2Fe2++2H+ | |
| D. | 向NH4Al(SO4)2溶液中加入Ba(OH)2溶液至SO42-恰好沉淀完全:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加人稀氨水,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| C. | 向水中加人少量固体NaCl,平衡逆向移动,c(H+)降低 | |
| D. | 将水加热,Kw增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 原电池的电极材料中必须至少有一极是金属 | |
| C. | 牺牲阳极的阴极保护法是利用了电解原理 | |
| D. | 用电解法精炼铜时,粗铜作阳极,纯铜作阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含有分子数相同 | B. | 所含有氧原子的个数相等 | ||
| C. | 所含有氢原子的个数不相等 | D. | 所含有原子的总数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中一定有氧元素参与 | |
| B. | 氧化还原反应中所有元素化合价都变化 | |
| C. | 氧化还原反应只有一种元素的化合价变化 | |
| D. | 氧化还原反应中电子有得必有失,化合价有升必有降 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
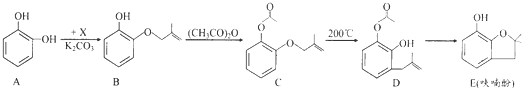
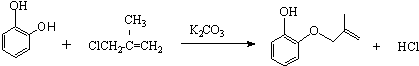 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{\;}^{12}C$ 与${\;}_{\;}^{14}C$互为同素异形体 | |
| B. | 金刚石与石墨互为同位素 | |
| C. | 二甲醚与乙醇互为同分异构体 | |
| D. | 乙烷与乙烯互为同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com