
| A. | 标准状况下,11.2L苯含有的分子数为0.5NA | |
| B. | 3.2gCH4含有的化学键数为0.4NA | |
| C. | 足量的O2与1molNa充分反应,转移的电子数为NA | |
| D. | 25℃时,1.0LpH=13的Ba(0H)2溶液中含有的0H-数为0.2NA |
分析 A.标准状况下,苯不是气体;
B.根据$\frac{m}{M}=n$计算甲烷的物质的量,每个甲烷分子含有4条C-H键;
C.根据Na$\stackrel{-e-}{→}$Na+计算;
D.pH=13的溶液中氢氧根离子浓度为0.1mol/L,1L该溶液中含有0.1mol氢氧根离子.
解答 解:A.标准状况下,苯不是气体,不能带入n=$\frac{V}{{V}_{m}}$计算,故A错误;
B.n(CH4)=$\frac{3.2g}{16g/mol}$=0.2mol,含有0.2NA个分子,每个甲烷分子含有4条C-H键,因此化学键数为0.8NA,故B错误;
C.钠与氧气反应时Na$\stackrel{-e-}{→}$Na+,1molNa失去NA个电子,因此转移电子数为NA,故C正确;
D.常温下,1.0L pH=13的Ba(OH)2溶液中氢氧根离子浓度为0.1mol/L,1L该溶液中含有0.1mol氢氧根离子,含有的OH-数目为0.1NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的综合应用,题目难度中等,明确标准状况下气体摩尔体积的使用条件、转移电子数以及pH的计算方法为解答关键.


科目:高中化学 来源: 题型:选择题

| A. | 2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量低 | |
| B. | 氢气的燃烧热为△H=-241.8 kJ•mol-1 | |
| C. | H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 | |
| D. | 液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | 部分特征 |
| A | 单质为相同条件下密度最小的气体 |
| B | 基态原子最外层电子排布式为nsnnpn |
| C | 与元素E处于同一周期且电负性仅次于E |
| D | 位于第三周期且第一电离能最小 |
| E | 双原子分子单质在标准状况下密度为1.4285g/L |
| F | 生活中常用的金属,在空气中表面通常形成一层致密的氧化膜 |
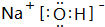 ;F的氧化物既可以和强酸反应也可以和强碱反应,试写出其氧化物与NaOH溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
;F的氧化物既可以和强酸反应也可以和强碱反应,试写出其氧化物与NaOH溶液反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纳米铜比纳米铁金属活动性更强 | |
| B. | 纳米铜在反应中可能作氧化剂 | |
| C. | 纳米TiO2在不同溶剂中均形成了胶体 | |
| D. | 纳米TiO2有很强的氯化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
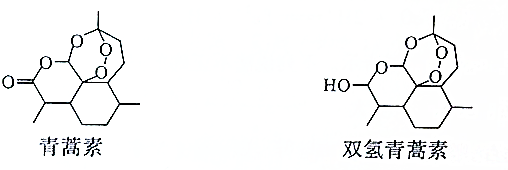
| A. | 双氢青篙素属于脂类物质 | |
| B. | 青蒿素的分子式为C15H21O5 | |
| C. | 青蒿素环上的一氯取代物有11种 | |
| D. | 青蒿素通过加成反应可以转化为双氢青蒿素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液A的体积(mL) | KMnO4标准溶液的体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 20.00 | 0.10 | 20.12 |
| 第二次 | 20.00 | 2.20 | 24.20 |
| 第三次 | 20.00 | 4.30 | 24.28 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
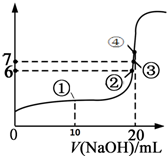 25℃时,向20mL 0.1mol/L的氢氟酸溶液中逐滴加入0.1mol/L NaOH溶液,滴加过程中混合溶液的pH变化曲线如图所示,回答下列问题:
25℃时,向20mL 0.1mol/L的氢氟酸溶液中逐滴加入0.1mol/L NaOH溶液,滴加过程中混合溶液的pH变化曲线如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA的浓度(mol/L) | NaOH的浓度(mol/L) | 混合溶液的PH |
| 甲 | 0.2 | 0.2 | PH=a |
| 乙 | C1 | 0.2 | PH=7 |
| 丙 | 0.1 | 0.1 | PH=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
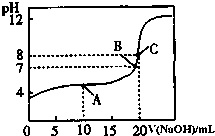 室温下:(1)pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”);
室温下:(1)pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”);查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com