
【题目】氮的化合物既是一种资源,也会给环境造成危害。
I.氨气是一种重要的化工原料。
(1)NH3与CO2在120°C,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)![]() (NH2)2CO(s)+H2O(g),ΔH= -x KJ/mol (x>0),其他相关数据如表:
(NH2)2CO(s)+H2O(g),ΔH= -x KJ/mol (x>0),其他相关数据如表:
物质 | NH3(g) | CO2(g) | CO(NH2)2(s) | H2O(g) |
1mol分子中的化学键断裂时需要吸收的能量/KJ | a | b | z | d |
则表中z(用x a b d表示)的大小为________。
(2)120℃时,在2L密闭反应容器中充入3mol CO2与NH3的混合气体,混合气体中NH3的体积分数随反应时间变化关系如图所示,该反应到达平衡时CO2的平均反应速率为_____, 此温度时的平衡常数为_____。

下列能使正反应的化学反应速率加快的措施有___________.
① 及时分离出尿素 ② 升高温度 ③ 向密闭定容容器中再充入CO2 ④ 降低温度
Ⅱ.氮的氧化物会污染环境。目前,硝酸厂尾气治理可采用NH3与于NO在催化剂存在的条件下作用,将污染物转化为无污染的物质。某研究小组拟验证NO能被氨气还原并计算其转化率(已知浓硫酸在常温下不氧化NO气体)。

(l)写出装置⑤中反应的化学方程式_________。
(2)装置①和装置②如下图,仪器A的名称为_____,其中盛放的药品名称为_______。

装置②中,先在试管中加入2-3 粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,加入石灰石的作用是________。
(3)装置⑥中,小段玻璃管的作用是______;装置⑦的作用是除去NO, NO与FeSO4溶液反应形成棕色[Fe(NO)]SO4溶液,同时装置⑦还用来检验氨气是否除尽,若氨气未除尽,可观察到的实验现象是_________。
【答案】 x-d+b+2a 0.0047mol/(L·s) 17.07 ②③ 4NH3+6NO![]() 5N2+6H2O 分液漏斗 浓氨水 产生CO2,排出装置中的空气,防止NO被氧化 防倒吸 溶液变浑浊
5N2+6H2O 分液漏斗 浓氨水 产生CO2,排出装置中的空气,防止NO被氧化 防倒吸 溶液变浑浊
【解析】I. (1)CO2(g)+2NH3(g)![]() (NH2)2CO(s)+H2O(g),反应中断裂反应物中的化学键吸收的能量为b+2a,形成生成物中的化学键放出的能量为z+d,ΔH=( b+2a)- (z+d)= -x KJ/mol,解得z= x-d+b+2a,故答案为:x-d+b+2a;
(NH2)2CO(s)+H2O(g),反应中断裂反应物中的化学键吸收的能量为b+2a,形成生成物中的化学键放出的能量为z+d,ΔH=( b+2a)- (z+d)= -x KJ/mol,解得z= x-d+b+2a,故答案为:x-d+b+2a;
(2)根据图像,起始时氨气的体积分数为50%,则氨气的物质的量为3mol×50%=1.5mol
CO2(g)+2NH3(g)![]() (NH2)2CO(s)+H2O(g)
(NH2)2CO(s)+H2O(g)
起始(mol)1.5 1.5 0
反应 x 2x x
平衡 1.5-x 1.5-2x x
则![]() ×100%=20%,解得:x=
×100%=20%,解得:x=![]() mol,到达平衡时CO2的平均反应速率=
mol,到达平衡时CO2的平均反应速率=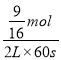 =0.0047mol/(L·s); 平衡常数K=
=0.0047mol/(L·s); 平衡常数K=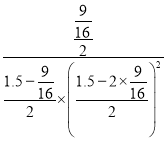 =17.07;① 及时分离出尿素,对反应速率没有影响;② 升高温度,能够加快反应速率;③ 向密闭定容容器中再充入CO2,二氧化碳的浓度增大,反应速率加快;④ 降低温度,反应速率减慢,能使正反应的化学反应速率加快的有②③,故答案为:0.0047mol/(L·s) ;17.07;②③;
=17.07;① 及时分离出尿素,对反应速率没有影响;② 升高温度,能够加快反应速率;③ 向密闭定容容器中再充入CO2,二氧化碳的浓度增大,反应速率加快;④ 降低温度,反应速率减慢,能使正反应的化学反应速率加快的有②③,故答案为:0.0047mol/(L·s) ;17.07;②③;
Ⅱ.(l)装置⑤干燥的氨气和一氧化氮在催化剂作用下反应生成氮气和水,反应的化学方程式为4NH3+6NO![]() 5N2+6H2O,故答案为:4NH3+6NO
5N2+6H2O,故答案为:4NH3+6NO![]() 5N2+6H2O;
5N2+6H2O;
(2)根据装置图,仪器A为分液漏斗,装置①是制备氨气的,需要在分液漏斗盛放浓氨水,在锥形瓶中放入氧化钙、氢氧化钠固体等物质;装置②中,先在试管中加入2-3 粒石灰石,注入适量稀硝酸,反应放出二氧化碳,排除装置中的空气,再塞上带有细铜丝的胶塞进行后续反应,故答案为:分液漏斗; 浓氨水;产生CO2,排出装置中的空气,防止NO被氧化;
(3)装置⑥中,小段玻璃管的作用是防止氨气易溶于水发生倒吸现象;装置⑦是用来检验氨气是否除净的装置,硫酸亚铁和氨气反应生成白色沉淀氢氧化亚铁,若氨气未除净,⑦中溶液中会生成氢氧化亚铁沉淀,则溶液变浑浊;故答案为:防倒吸;⑦中溶液变浑浊。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】实验室用如图所示的装置制取乙酸乙酯.
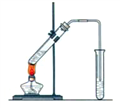
(1)浓硫酸的作用①________;②__________
(2)右边收集试管内装有__________,该溶液的作用是:
①________________②_____________③____________。
(3)实验生成的乙酸乙酯其密度比水____(填“大”或“小”),有____气味.
(4)制取乙酸乙酯的反应方程式是:_______________________________________
(5)若实验中温度过高,使反应温度达到140℃左右时,副反应的主要有机产物是____(填物质的名称).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到的密度为1.15g·cm-3的混合溶液。计算:
(1)混合后溶液的质量分数___________。
(2)混合后溶液的物质的量浓度_____________。
(3)在1000g水中需溶解_____________摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2被称为绿色氧化剂。下图是以甲烷燃料电池为电源,电解制备H2O2的示意图。下列有关叙述中正确的是

A. 电解池装置应选择阳离子交换膜
B. d 极的电极反应式为:O2+2e-+2H+=H2O2
C. 当有16g甲烷参与原电池反应时,可制备4 mol H2O2
D. 工作时,a、c电极附近的pH均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是 ( )
A. 铜合金有青铜,黄铜和白铜等
B. 合金具有优良的物理,化学或机械性能,但其熔点一般低于它的成分金属
C. 铝在纯氧气中能剧烈燃烧,火星四射,生成熔融的氧化铝
D. 生铁、普通钢和不锈钢中的含碳量依次降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于混合物分离和提纯的装置。

回答下列问题:
(1)从氯化钾溶液中得到氯化钾固体,选择装置____________(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置____________。从碘水中分离出I2,选择装置___________,该分离方法的名称为_________________。
(2)装置A中①的名称是________,进水的方向是____________。温度计水银球的位置是在__________;装置B在分液时,打开活塞后发现液体不能顺利滴下,其可能的原因是__________。。
(3)从碘水中得到碘时,不能选用的试剂是______(填字母)。
A.酒精 B.苯 C.四氯化碳
(4)若选择试剂X(密度小于水的密度)从碘水中提取碘时,充分振荡、静置后。下层液体的颜色为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列有关说法错误的是
A. “地沟油”可以转化为生物柴油,提高资源的利用率
B. 丝绸和棉花的组成元素不完全相同
C. 木糖醇虽然有甜味,但不属于糖类
D. 向牛奶中加入果汁会出现沉淀,这是因为发生了中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是
A. 直线形;三角锥形 B. V形;三角锥形
C. 直线形;平面三角形 D. V形;平面三角形
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com