
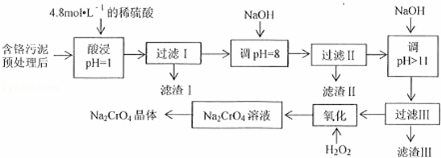
某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺流程如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Mg2+):
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO42﹣形式存在且易氧化;
②常温下,部分阳离子以氢氧化物形式沉淀是溶液的pH如下:
阳 Fe Mg Al Cr
开始沉淀时的H 1.9 9.0 ﹣﹣ ﹣﹣
沉淀完全时的H 3. 11.1 8 9(>9溶解)
(1)实验室用18.4mol•L﹣1的浓硫酸配制250mL 4.8mol•L﹣1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需量 ;
(2)滤渣II是 ,过滤II步骤能否省略,为什么?
.
(3)写出滤液中加入H2O2发生反应的两种方程式 ;
(4)取得到的Na2CrO4晶体0.48g,加入硫酸溶液得到Na2CrO溶液,用0.3000 mol•L﹣1滴定至终点时(铬被还原为Cr3+),消耗20.00mL标准溶液.
①盛装FeSO4标准溶液应用酸式滴定管(填“酸式”或“碱式”),滴定时的操作为:
②计算该产品中Na2CrO4的质量分数为 .
考点: 物质分离和提纯的方法和基本操作综合应用.
分析: 含铬污泥预处理后,酸浸溶解,用NaOH调节pH=8,Al3+、Fe3+完全沉淀,过滤除去Fe(OH)3、Al(OH)3;再调节pH>11,沉淀Mg2+,加入双氧水,Cr3+能被双氧水氧化为Na2CrO4溶液,蒸发浓缩,冷却结晶,得到Na2CrO4晶体.
(1)依据溶液配制的步骤和过程分析所用到的仪器,主要仪器应有配制溶液的容量瓶和定容需要的胶头滴管;配置一定物质的量浓度的溶液所需的玻璃仪器有:烧杯、玻璃棒、吸量管、容量瓶和胶头滴管;
(2)用NaOH调节pH=8,Al3+、Fe3+完全沉淀;不能省略过滤Ⅱ,若不经过滤除去,当继续加入NaOH时,Al(OH)3会溶解,引入杂质离子AlO2﹣;
(3)根据双氧水的性质分析,双氧水有强氧化性,能氧化还原性的物质,依据氧化还原反应电子守恒、原子守恒配平书写离子方程式;
(4)①FeSO4标准溶液显酸性,用酸式滴定管盛放;
②滴定时,左手控制活塞,右手震荡锥形瓶,眼睛注视锥形瓶内颜色变化,滴定至终点时,记录标准液的体积;
③根据滴定关系式计算:Na2CrO4~3FeSO4.
解答: 解:含铬污泥预处理后,酸浸溶解,用NaOH调节pH=8,Al3+、Fe3+完全沉淀,过滤除去Fe(OH)3、Al(OH)3;再调节pH>11,沉淀Mg2+,加入双氧水,Cr3+能被双氧水氧化为Na2CrO4溶液,蒸发浓缩,冷却结晶,得到Na2CrO4晶体.
(1)配置一定物质的量浓度的溶液所需的玻璃仪器有:烧杯、玻璃棒、量筒、吸量管、容量瓶和胶头滴管,
故答案为:量筒、250mL容量瓶、胶头滴管;
(2)用NaOH调节pH=8,Al3+、Fe3+完全沉淀,故滤渣Ⅱ是Fe(OH)3、Al(OH)3;不能省略过滤Ⅱ,若不经过滤除去,当继续加入NaOH时,Al(OH)3会溶解,引入杂质离子AlO2﹣;
故答案为:Fe(OH)3、Al(OH)3;不能,当pH=8时,Al3+已经完全转化为沉淀,若不经过滤除去,当继续加入NaOH时,Al(OH)3会溶解,引入杂质离子AlO2﹣;
(3)双氧水有强氧化性,能氧化还原性的物质,Cr3+有还原性,Cr3+能被双氧水氧化为高价离子,以便于与杂质离子分离,反应的离子方程式:2Cr3++3H2O2+H2O=Cr2O72﹣+8H+;
故答案为:2Cr3++3H2O2+H2O=Cr2O72﹣+8H+;
(4)①FeSO4标准溶液显酸性,用酸式滴定管盛放;故答案为:酸式;
②滴定时,左手控制活塞,右手震荡锥形瓶,眼睛注视锥形瓶内颜色变化,滴定至终点时,记录标准液的体积;
故答案为:左手控制活塞,右手震荡锥形瓶,眼睛注视锥形瓶内颜色变化,滴定至终点时,记录标准液的体积;
③根据滴定关系式:Na2CrO4~3FeSO4
1 3
n 0.300mol/L×0.020L,解之得n=0.002mol
m(Na2CrO4)=0.002mol×162g/mol=0.324g
该产品中Na2CrO4的质量分数为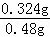 ×100%=66.67%;
×100%=66.67%;
故答案为:66.67%.
点评: 本题考查了离子方程式、化学方程式的书写、物质的分离等知识点,注意会运用溶液的PH值对溶液中的离子进行分离,除杂的原则是除去杂质且不引进新的杂质,本题难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,SO42﹣的物质的量浓度为0.7mol/L,则此溶液中K+的物质的量浓度为( )
|
| A. | 0.1mol/L | B. | 0.15mol/L | C. | 0.2mol/L | D. | 0.25mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分离提纯的方法正确的是()
A. 除去氯化铵中的碘,用升华的方法
B. 用酒精提取碘水中的碘
C. 分馏法分离乙醇和乙酸
D. 用重结晶法除去硝酸钾中的氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究乙炔与溴的加成反应,甲同学涉及并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应.
请你回答下列问题:
(1)写出甲同学实验中生成乙炔气体的化学方程式 .
(2)为了减缓电石与水的反应速率,实验时用 代替水.
(3)甲同学设计的实验不能(填能或不能)验证乙炔与溴发生加成反应,其理由是 .
A.使溴水褪色的反应,未必是加成反应
B.使溴水褪色的反应,就是加成反应
C.使溴水褪色的物质,未必是乙炔
D.使溴水褪色的物质,就是乙炔
(4)乙同学推测此乙炔中必定含有的一种杂质气体是H2S,它与溴水反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某聚合物锂离子充电电池放电时的反应为:Li1﹣xCoO2+LixC6=6C+LiCoO2,(LixC6表示锂原子嵌入石墨形成的复合材料)其工作原理如图所示,下列说法正确的是()
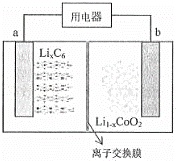
A. 放电时,电子从b极流向a极
B. 放电时,a极脱出的离子通过阴离子交换膜从左向右移动
C. 充电时,b极发生的反应为:LiCoO2﹣xe﹣=Li1﹣xCoO2+xLi+
D. 充电时,每转移x mol 电子,产生6mol碳单质
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)()
A. 阳极发生还原反应,其电极反应式:Ni2++2e﹣═Ni
B. 电解过程中,阳极质量的减少与阴极质量的增加相等
C. 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D. 电解后,电解槽底部的阳极泥中只有Cu和Pt
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学反应的△H=+122kJ•mol﹣1,△S=﹣231J•mol﹣1•K﹣1,则此反应在下列哪种情况下可自发进行()
A. 在任何温度下都能自发进行
B. 在任何温度下都不能自发进行
C. 仅在高温下自发进行
D. 仅在低温下自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A→B;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2﹣+2e﹣→E,B﹣2e﹣→B2+则A、B、D、E金属性由强到弱的顺序为()
A. A>B>E>D B. A>B>D>E C. D>E>A>B D. D>A>B>E
查看答案和解析>>
科目:高中化学 来源: 题型:
对相同状况下的12C18O和14N2两种气体,下列说法正确的是()
A. 若质量相等,则质子数相等
B. 若原子数相等,则中子数相等
C. 若分子数相等,则体积 相等
相等
D. 若体积相等,则密度相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com