
【题目】下列有关化学与自然资源的开发利用说法中不正确的是( )
A. 海水提溴是将海水中的化合态的溴富集再转化为游离态的溴
B. 石油裂化的主要目的是提高汽油的产量
C. 煤干馏的产品很多,是一个化学変化
D. 海水提镁的过程为:MgCl2(aq)![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知某“84 消毒液”瓶体部分标签如图所示,该“84 消毒液”通常稀释 100 倍(体积之比)后使用。请回答下列问题:

(1)该“84 消毒液”的物质的量浓度约为_________________mol·L-1。(保留两位有效数字)
(2)某同学取 100 mL 该“84 消毒液”,稀释后用于消毒,稀释后的溶液中 c(Na+)=________ mol·L-1。
(3)该同学参阅该“84 消毒液”的配方,欲用 NaClO 固体配制 250 mL含 NaClO 质量分数为 25%的消毒液。下列说法不正确的是______________(填序号)。
a.如图所示的仪器中,有三种是不需要的,还需要其它玻璃仪器
b.仪器E用蒸馏水洗净后,应烘干后才能用于溶液配制
c.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
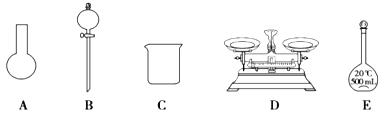
(4)仪器 E 使用前必须__________________。仪器 E上标记有________(填序号); ①质量 ②温度 ③刻度线 ④浓度 ⑤容积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某容积固定的密闭容器中,建立下列化学平衡:C(s)+H2O(g)![]() CO(g)
CO(g)
+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )
A. 体系的压强不再发生变化
B. v正(CO)=v逆(H2O)
C. 生成n mol CO的同时生成n mol H2
D. 1 mol H—H键断裂的同时断裂2 mol H—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝(熔点660℃)是一种应用广泛的金属,镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业上以铝土矿(含有Al2O3、Ga2O3、SiO2等物质)为原料提取Al2O3(熔点2045℃),并将Al2O3和冰晶石(Na3AlF6,六氟合铝酸钠)混合熔融后电解制得。回答下列问题:
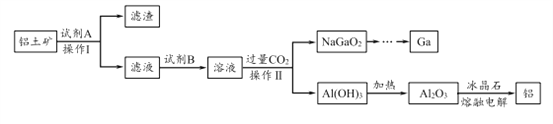
(1)冶金工业上常用金属铝作还原剂冶炼钒、铬、锰等金属,写出铝与CrO3在高温下反应的化学方程式 ___________________。
(2)操作I得到滤渣的主要成分有________________ 。
(3)将0.1 mol/L AlCl3溶液和10% NH4F溶液等体积混合,充分反应后滴加氨水,无沉淀析出。则AlCl3与NH4F反应的化学方程式为 ________________ ;该实验所用试管及盛装NH4F溶液的试剂瓶均为塑料材质,原因是 _________________________。
(4)饮用水中的NO3-对人类健康会产生危害。为了降低饮用水中的NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为_________ ,此方法的缺点是处理后的水中生成了AlO2-,仍然可能对人类健康产生危害,还需对该饮用水进行一系列后续处理。已知:25℃时,Ksp[Al(OH)3]=1.3×10-33,Al(OH)3![]() AlO2-+H++H2O K=1.0×10-13。25℃时,若欲使上述处理的水中AlO2-浓度降低到1.0×10-6 mol/L,则应调节至pH=____,此时水中
AlO2-+H++H2O K=1.0×10-13。25℃时,若欲使上述处理的水中AlO2-浓度降低到1.0×10-6 mol/L,则应调节至pH=____,此时水中![]() =__________。
=__________。
(5)工业上常用碳棒作电极电解熔融氧化铝的方法冶炼铝(如图所示)。
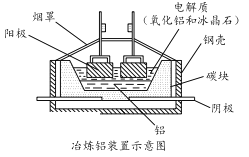
①阴极电极反应式为________________________ 。
②工业生产中,阳极材料要定期补充,其原因是:____________________。
(6)下列有关推理不合理的是 ______。
a.工业上可以用热还原法来制取Ga
b.酸性:Al(OH)3>Ga(OH)3
c.由最外层电子数相同可知,镓与铝的化学性质相似
d.可用GaCl3溶液、氨水和盐酸设计实验证明Ga(OH)3的两性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+4B(g)![]() C(g)+D(g),在四种不同情况下的反应速率如下,其中反应进行最快的是( )
C(g)+D(g),在四种不同情况下的反应速率如下,其中反应进行最快的是( )
A. vA=0.15mol/(L·min) B. vB=0.02mol/(L·s)
C. vC=0.2mol/(L·min) D. vD=0.01mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学习化学反应速率后,联想到H2O2分解制备氧气,设计如下实验方案探究外界条件对反应速率的影响。
编号 | 温度 | 反应物 | 催化剂 |
甲 | 25℃ | 试管中加入3mL5%H2O2溶液 | 1mL蒸馏水 |
乙 | 25℃ | 试管中加入3mL5%H2O2溶液 | 1mL0.1mol/LFeCl3溶液 |
丙 | 40℃ | 试管中加入3mL5%H2O2溶液 | 1mL蒸馏水 |
(1)实验乙中发生反应的化学方程式为_______________。
(2)实验甲和实验乙的实验目的是____________。实验甲和实验丙的实验目的是___________。
(3)实验过程中该同学对实验乙中产生的气体进行收集,并在2min内6个时间点对注射器内气体进行读数,记录数据如下表。
时间/s | 20 | 40 | 60 | 80 | 100 | 120 | |
气体体积/mL | 实验乙 | 15.0 | 29.5 | 43.5 | 56.5 | 69.5 | |
0~20s的反应速率v1=__________mL/s,100~120s的反应速率v2=__________mL/s。不考虑实验测量误差,二者速率存在差异的主要原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是
2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是
A. 2v (NH3)=v (CO2)
B. 密闭容器中气体密度不变
C. 密闭容器中混合气体的平均摩尔质量不变
D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com