
在由水电离的c(H+)=10-14 mol·L-1的溶液中,一定能大量共存的离子组是( )
A.K+、Fe2+、S、MnO4—
B.Na+、Cl-、NO3—、SO42—
C.Al3+、NO3—、Cl-、SO42—
D.Na+、AlO2—、Br-、Cl-
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源:2014年高二化学人教版选修四 1化学反应与能量的变化练习卷(解析版) 题型:选择题
根据化学反应的实质是旧键的断裂和新键的形成这一现实,下列变化不属于化学反应的是( )
A.白磷在260 ℃时转化为红磷B.石墨在高温下转化为金刚石
C.NaCl熔化D.五氧化二磷吸水
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 15盐类水解的原理练习卷(解析版) 题型:填空题
25 ℃时,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① _________________________;
② _________________________;
③ _________________________。
(2)溶液中共有 种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01 mol·L-1的是 ,浓度为0.002 mol·L-1的是 。
(4) 和 两种粒子物质的量之和等于0.01 mol。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 14酸碱中和滴定练习卷(解析版) 题型:选择题
实验室现有3种酸碱指示剂,其pH变色范围如下
甲基橙:3.1~4.4
石蕊:5.0~8.0
酚酞:8.2~10.0
用0.100 0 mol·L-1 NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是( )
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 13pH的计算练习卷(解析版) 题型:选择题
常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于( )
A.1.7B.2.0C.12.0D.12.4
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 12水的电离 溶液的酸碱性练习卷(解析版) 题型:选择题
水的电离过程为H2O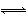 H++OH-,在25 ℃时水的离子积为KW=1.0×10-14,在35 ℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是( )
H++OH-,在25 ℃时水的离子积为KW=1.0×10-14,在35 ℃时水的离子积为KW=2.1×10-14,则下列叙述正确的是( )
A.c(H+)随着温度的升高而降低
B.35 ℃时c(H+)>c(OH-)
C.35 ℃时的水比25 ℃时的水电离程度小
D.水的电离是个吸热过程
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 11弱电解质的电离练习卷(解析版) 题型:选择题
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
从表格中判断以下说法中不正确的是( )
A.在冰醋酸中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4 2H++S
2H++S
D.水对于这四种酸的强弱没有区分能力,但在醋酸中可以区别这四种酸的强弱
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修二 模块综合检测练习卷(解析版) 题型:填空题
某研究小组设计如下工艺路线提纯工业碳酸钠。已知工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-、和SO42—等杂质。
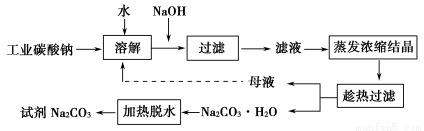
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
Ⅱ.有关物质的溶度积如下:
物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
根据所给信息,回答下列问题:
(1)加入NaOH溶液时发生的离子方程式为___________________________。
向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+)∶c(Fe3+)=__________________________________________
(2)“趁热过滤”时的温度应控制在____________________________________
(3)有人从“绿色化学”的角度设想将“母液”沿流程中虚线所示进行循环使用。请你分析实际工业生产中是否可行__________________,并说明理由_______________________________________
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修二 3单元综合检测练习卷(解析版) 题型:填空题
Ⅰ.有机黏合剂是生产和生活中的一类重要的材料。黏合过程一般是液态的小分子黏合剂经化学反应转化为高分子而固化。
(1)“502胶”是一种快干胶,其主要成分为α?氰基丙烯酸乙酯[CH2=C(CN)COOCH2CH3]。在空气中微量水催化下发生加聚反应,迅速固化而将物体粘牢。请写出“502胶”发生黏合作用的化学方程式:________________________________________。
(2)厌氧胶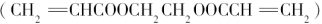 也是一种黏合剂,在空气中稳定存在,但在隔绝空气(缺氧)时,分子中双键断开发生聚合而固化。工业上用丙烯酸和某种物质A在一定条件下反应可制得这种黏合剂。则A的结构简式为:_____________。
也是一种黏合剂,在空气中稳定存在,但在隔绝空气(缺氧)时,分子中双键断开发生聚合而固化。工业上用丙烯酸和某种物质A在一定条件下反应可制得这种黏合剂。则A的结构简式为:_____________。
(3)白乳胶是常用的黏合剂,其主要成分是醋酸乙烯酯(CH3COOHC=CH2),它有很多同分异构体。试写出属于酯类的任意两种同分异构体_____________、_____________。
Ⅱ.聚甲基丙烯酸甲酯也是一种重要的医用高分子材料,用于人造骨、关节等。已知烯烃可被KMnO4酸性溶液氧化成二元醇,如:
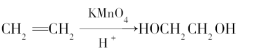
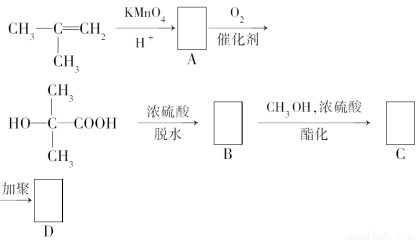
现以甲基丙烯为原料合成有机玻璃树脂,流程如下。
请在下列方框中填入合适的有机物结构简式。
Ⅲ.已知苯酚和甲醛在催化剂作用下可发生缩聚反应,生成酚醛树脂(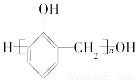 )。
)。
(1)写出该反应的化学方程式:____________。
(2)酚醛树脂一般为体型结构,试推测其基本性质:①溶解性:________;②热塑性和热固性:____________;③强度:__________;④电绝缘性:________。
(3)某种合成酚醛树脂的结构简式为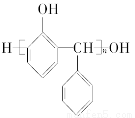 ,则合成它的单体是__________、________。
,则合成它的单体是__________、________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com