
通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下列是一些化学键的键能。
| 化学键 | C—H | C—F | H—F | F—F |
| 键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
根据键能数据估算下列反应CH4(g)+4F2(g)===CF4(g)+4HF(g)的反应热ΔH为]
A.-1940kJ·mol-1 B.1940kJ·mol-1 C.-485kJ·mol-1 D.485kJ·mol-1
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
请完成下面两个小题:
Ⅰ.(6分)反应m A+n B p C在某温度下达到平衡。
p C在某温度下达到平衡。
① 若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是______ _________。
② 若C为气体,且m + n = p,在加压时化学平衡发生移动,则平衡必定向_____方向移动。
③ 如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为_____态。.
Ⅱ.(11分)在一定温度下,在一体积固定的密闭容器中加入2 mol X和1 mol Y,发生如下反应:
2X(g)+Y(g) a Z(g)+W(g) ΔH=-Q kJ·mol-1(Q>0)
a Z(g)+W(g) ΔH=-Q kJ·mol-1(Q>0)
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值是____________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为____________(a为整数)。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?____(填“是或否”)其理由是__________________________________。
(4)维持温度不变,能引起c(X)/c(W)减小的操作有( )
A.加入X
B.加入Y
C.增大压强
D.充入He气
(5)X的转化率α=____________(用含Q、Q1的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
将钠、镁、铝各0.3 mol,分别放入100 mL 1 mol·L—1的硫酸中,同温同压下产生的气体的体积比是( )
A.1∶2∶3 B.6∶3∶2 C.3∶2∶2 D.3∶1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
工业以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。
(1)写出该实验制备纯碱的反应方程式 、 。
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
(填字母标号)。a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
d.碳酸氢钠的稳定性大于碳酸钠
(3)某活动小组根据上述制碱原理,进行碳酸氢钠的制备实验。
① 一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验
装置如下图所示(图中夹持、固定用的仪器未画出)。试回答下列有关问题:
(Ⅰ)乙装置中的试剂是 ,其作用是 ;
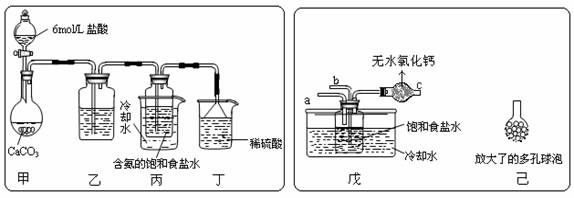 (Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅱ)丁装置中稀硫酸的作用是 ;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是 (填分离操作的名称),该操作所需要的玻璃仪器有
② 另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从a管通入_______气体,说明原因_________________________
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
(4) 碳酸氢钠受热所得固体12.28g与足量的石灰水充分反应,所得沉淀经洗
涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式
N2 + 3H2 = 2NH3 ΔH=—92.4 KJ/mol,则N≡N键的键能是 ( )
A.431 KJ/mol B.946 KJ/mol C.649 KJ/mol D.869 KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
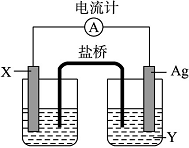 (1)电极X的材料是______;电解质溶液Y是______;
(1)电极X的材料是______;电解质溶液Y是______;
(2)银电极为电池的______极,发生的电极反应为______________;X电极上发生的电极反应为________________________________________;
(3)硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。(1)将烧碱吸收H2S后的溶液加入到如题20图—1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2-—2e- S
S
(n—1)S+ S2- Sn2-
Sn2-
①写出电解时阴极的电极反应式:_________________________
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成
__________________________________________________________________
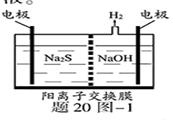
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关氧化还原反应的叙述中正确的是 ( )。
A.有单质参加或有单质生成的反应一定是氧化还原反应
B.氧化还原的本质是元素化合价的升降
C.失电子的反应物在反应中作氧化剂,反应中被还原
D.金属单质在化学反应中一定作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应2HI(g) I2(g)+H2(g)在密闭容器中进行,当下列中的四项中的某项不随时间变化时,不能说明反应达到平衡的是( )
I2(g)+H2(g)在密闭容器中进行,当下列中的四项中的某项不随时间变化时,不能说明反应达到平衡的是( )
A.各组分的物质的量 B.混合物的温度 C.容器内压强 D.混合气体的颜色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com