
| 0.2mol |
| 2L |
| 0.2mol |
| 2L |
| ||
| 1 |
| 2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、苯酚中滴加少量的稀溴水出现了三溴苯酚的白色沉淀 |
| B、检验C2H5Cl中氯原子时,将C2H5Cl和NaOH溶液混合加热后,加入稀硫酸进行酸化 |
| C、用无水乙醇和浓H2SO4共热至140℃可以制得乙烯气体 |
| D、制取溴苯应用液溴、铁屑和苯混合,反应后并用稀碱液洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
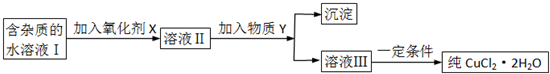
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将混合气体通过盛有硫酸的洗气瓶 |
| B、将混合气体通过盛有足量溴水的洗气瓶 |
| C、将混合气体通过盛有酸性KMnO4溶液的洗气瓶 |
| D、将混合气体通过盛有澄清石灰水的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | Mn | F | |
| 电离能 (kJ?mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | a | b | |
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
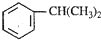 是一种重要的有机化工原料.根据题意完成下列
是一种重要的有机化工原料.根据题意完成下列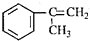 是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法
是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到.写出由异丙苯制取该单体的另一种方法查看答案和解析>>
科目:高中化学 来源: 题型:
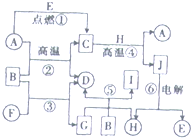 物质A~J之间的转化关系如图所示,其中A、F、H为常见的金属单质,D、E为常见的非金属气态单质,其余的为化合物,且单质E和单质F在点燃条件下可生成淡黄色固体,B在常温常压下为液态化合物.试回答下列问题:
物质A~J之间的转化关系如图所示,其中A、F、H为常见的金属单质,D、E为常见的非金属气态单质,其余的为化合物,且单质E和单质F在点燃条件下可生成淡黄色固体,B在常温常压下为液态化合物.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、υ(NH4)=0.8 mol/(L?s) |
| B、υ(O2)=1.0 mol/(L?s) |
| C、υ(NO)=1.0 mol/(L?s) |
| D、υ(H2O)=1.8 mol/(L?s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com