
| A. | SO2使溴水褪色,显示了SO2的漂白性 | |
| B. | SO2使溴水褪色,显示了SO2的还原性 | |
| C. | 从溴水中提取单质溴,可以用乙醇进行萃取 | |
| D. | SO2是形成酸雨的唯一污染物 |
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{2}^{3}He$原子核内有2个中子 | |
| B. | ${\;}_{2}^{3}He$原子核外有3个电子 | |
| C. | ${\;}_{3}^{4}He$原子核内有3个质子 | |
| D. | ${\;}_{2}^{3}He$和${\;}_{2}^{4}He$是两种不同的核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在高温高压下,28 gN2和6g H2充分反应生成NH3的分子数为2NA | |
| B. | 1mol/LFeCl3 溶液中所含Fe3+的数目小于NA | |
| C. | 常温下,1L pH=12的Ba(OH)2 溶液中含OH-的数目为2NA | |
| D. | 23g NO2和N2O4的混合气体中含有氮原子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在CH2=CH2分子中,存在五个s-sp2σ键和一个π键 | |
| B. | N、O、F电负性大小:F>O>N;第一电离能大小:F>O>N | |
| C. | 酸性强弱:H2SO4>H2SO3>H2SeO3;岩浆晶出的先后顺序:SiO2、MgSiO3、CaSiO3 | |
| D. | 在共价化合物中,一定存在极性共价键,可能存在非极性共价键,一定不存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、石油、天然气都是化石能源 | |
| B. | 氢能、核能都是无污染的可再生能源 | |
| C. | 氢能是可再生能源 | |
| D. | 化石能源是非再生能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
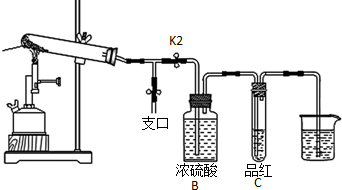
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
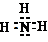 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com