
向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应后,则参加反应的NaOH的物质的量为________;原NaOH溶液的物质的量浓度为________;生成标准状况下H2的体积为__________。
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
下列每组中各有三对物质,它们都能用分液漏斗分离的是
( )。
A.乙酸乙酯和水,酒精和水,乙酸和水
B.溴苯和水,甲苯和苯,油酸和水
C.硬脂酸和水,乙酸和水,乙酸和乙醇
D.乙酸乙酯和水,甲苯和水,苯和水
查看答案和解析>>
科目:高中化学 来源: 题型:
将1.12 g铁粉加入25 mL 2 mol/L的FeCl3溶液中,充分反应后,其结果是( )
A.铁粉有剩余,溶液呈浅绿色,Cl-基本保持不变
B.往溶液中滴入无色KSCN溶液,不显红色
C.Fe2+和Fe3+物质的量之比为6∶1
D.氧化产物和还原产物的物质的量之比为2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W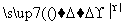 X+H2O+CO2↑ ②Z+CO2―→X+O2
X+H2O+CO2↑ ②Z+CO2―→X+O2
③Z+H2O―→Y+O2↑ ④X+Ca(OH)2―→Y+CaCO3↓
试回答下列问题:
(1)W、X、Y、Z的化学式分别是:
W:________、X:________、Y:________、Z:________。
(2)以上4个化学反应,属于氧化还原反应的是________(填反应序号),反应中氧化剂是________(写化学式),还原剂是________(写化学式)。
(3)若④反应在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:
离子方程式:____________________________________________________________。
化学方程式:___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常用作风信子等香精的定香剂D以及可用作安全玻璃夹层的高分子化合物PVB的合成路线如下:
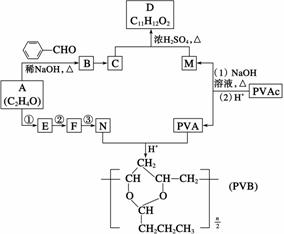
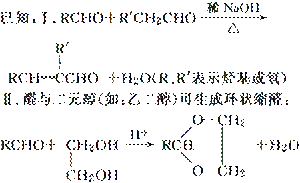
(1)A的核磁共振氢谱有两种峰。A的名称是________。
(2)A与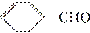 合成B的化学方程式是________________________________________。
合成B的化学方程式是________________________________________。
(3)C为反式结构,由B还原得到。C的结构式是____________________________________。
(4)E能使Br2的CCl4溶液褪色。N由A经反应①~③合成。
a.①的反应试剂和条件是_________________________________________________。
b.②的反应类型是__________。
c.③的化学方程式是_____________________________________________________。
(5)PVAc由一种单体经加聚反应得到,该单体的结构简式是_____________________。
(6)碱性条件下,PVAc完全水解的化学方程式是______________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制取硫酸铜不是直接用浓硫酸与铜反应,而是将铜丝浸入稀硫酸中并不断地从容器下部吹入细小的空气泡,这样做的优点是
( )。
①节省能源 ②不产生污染大气的SO2 ③提高了H2SO4的利用率 ④提高了Cu的利用率
A.①② B.③④ C.①②③ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
天然海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、S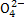 、Br-、C
、Br-、C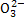 、HC
、HC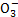 等离子,火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如图所示:
等离子,火力发电燃煤排放的含SO2的烟气可利用海水脱硫,其工艺流程如图所示:
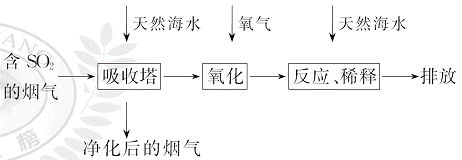
下列说法错误的是( )
A.天然海水pH≈8的原因是海水中的C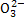 、HC
、HC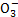 水解
水解
B.“氧化”是利用氧气将HS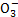 、S
、S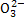 等氧化生成S
等氧化生成S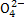
C.“反应、稀释”时加天然海水的目的是中和、稀释经氧气氧化后海水中生成的酸
D.“排放”出来的海水中S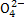 的物质的量浓度与进入吸收塔的天然海水相同
的物质的量浓度与进入吸收塔的天然海水相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com