
A.在硫酸铜晶体结晶水含量的 测定实验中,加热后的硫酸铜应在空气中冷却后 测定实验中,加热后的硫酸铜应在空气中冷却后 再称量 再称量 |
| B.在中和热的测定实验中,应用稀的强酸和强碱作为反应物进行实验 |
| C.在Fe(OH)3胶体的电泳实验中,靠近阴极附近的液体的颜色会加深 |
| D.在硫酸铜晶体结晶水含量的测定实验中,加热不够充分将会使实验结果偏小 |
科目:高中化学 来源:不详 题型:实验题
| 选项 | 铝电极 | 电解质 | 负极反应 | 正极反应 |
| A | 正极 | NaOH | Al-3e-=Al3+ | 2H2O+2e-=2OH-+H2↑ |
| B | 负极 | 稀盐酸 | 2Al-6e-=2Al3+ | 6H++6e-=3H2↑ |
| C | 正极 | 浓硝酸 | Cu-2e--=Cu2+ | 2NO3-+4H+-4e-=2NO2↑+2H2O |
| D | 负极 | 稀硝酸 | Cu-2e-=Cu2+ | 2NO3-+8H+=2NO↑+4H2O+6e- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
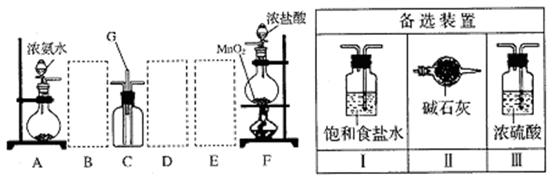
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
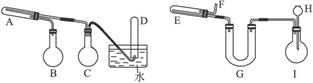
 (近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量
(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量 m(H20),由此计算
m(H20),由此计算 。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):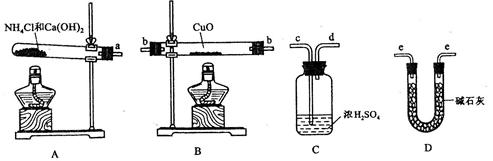
 的是_______________ (填序号);
的是_______________ (填序号); 干燥
干燥 _____和_______________达到实验目的。
_____和_______________达到实验目的。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验操作 | 现象 | 结论 |
| 步骤一: | 产生蓝色沉淀 | |
| 步骤二: | | “猜想二”成立 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 是 ( )
是 ( )| A.用无水乙醇从碘水中提取单质碘 |
B.稀释浓 硫酸时,应将浓硫酸缓缓注入盛有水的量筒中 硫酸时,应将浓硫酸缓缓注入盛有水的量筒中 |
| C.配制.FeCl3溶液时,向溶液中加入少量Fe和稀盐酸 |
| D.提纯混有少量乙酸的乙醇,可先加生石灰再蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com