
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| P>S | O2->Na+ | CaO<MgO | HClO4>H2SO4 |
分析 (1)第34号元素是硒,其元素符号是Se;根据基态原子核外电子排布式中最后填入电子名称确定区域名称,铬元素其价层电子的轨道表示式是 ;
;
(2)周周期从左到右第一电离能增大,但ⅡA,ⅤA族出现异常;电子层结构相同,核电荷数越多半径越小;晶格能越大熔沸点越高,电荷数越多,半径越小,晶格能越大;元素非金属性越强最高价氧化物对应水化物的酸性越强;
(3)在O、Na、P、Cl四种元素中,氧的非金属性最强,PCl3分子中中心原子磷形成三个σ键和一对孤对电子对,所以立体结构是三角锥形,中心原子是sp3杂化,价层电子对数=σ键电子对数+孤电子对数;
(4)①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,分子晶体的是①CO2,⑤CS2,金属晶体的是③Na,离子晶体的是②NaCl,原子晶体的是④Si,⑥金刚石;分子晶体熔化时不破坏化学键,原子晶体熔化时破坏共价键.
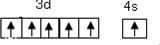
解答 解:(1)第34号元素是硒,其元素符号是Se;铬最后填充的是3d,所以铬位于d区,铬元素其价层电子的轨道表示式是 ,故答案为:Se;d;
,故答案为:Se;d; ;
;
(2)周周期从左到右第一电离能增大,但ⅡA,ⅤA族出现异常,P是第ⅤA族元素,所以第一电离能:P>S;电子层结构相同,钠的核电荷数多所以半径 O2->Na+越小;镁离子的半径小于钙离子,所以晶格能MgO大于CaO,则熔点MgO高;元素非金属性氯强于硫,所以酸性HClO4>H2SO4,故答案为:>;>;<;>;
(3)在O、Na、P、Cl四种元素中,氧的非金属性最强,PCl3分子中中心原子磷形成三个σ键和一对孤对电子对,所以立体结构是三角锥形,中心原子是sp3杂化,价层电子对数=σ键电子对数+孤电子对数=3+1=4,故答案为:O;三角锥形;sp3;4;
(4)①CO2,②NaCl,③Na,④Si,⑤CS2,⑥金刚石,分子晶体的是①CO2,⑤CS2,金属晶体的是③Na,离子晶体的是②NaCl,原子晶体的是④Si,⑥金刚石,所以有四种类型的晶体,分子晶体熔化时不破坏化学键,原子晶体熔化时破坏共价键,故答案为:4;①⑤;④⑥.
点评 本题考查物质结构和性质,元素周期律、熔点高低判断、晶体类型的判断方面考查,熟练掌握典型晶体结构,会根据物质构成微粒判断晶体类型,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NO2通FeSO4溶液中 | B. | NH3通入AlC13溶液中 | ||
| C. | CO2通入CaC12溶液中 | D. | SO2通人已酸化的Ba(NO3)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 香兰素的结构简式如图所示,有宜人的芳香气味,是制作巧克力的辅助原料,下列关于香兰素的判断不正确的是( )
香兰素的结构简式如图所示,有宜人的芳香气味,是制作巧克力的辅助原料,下列关于香兰素的判断不正确的是( )| A. | 分子式为C8H8O3 | B. | 可与银氨溶液反应 | ||
| C. | 可与NaOH溶液反应 | D. | 分子中所有原子都在同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.04 mol•L-1 | B. | 0.5 mol•L-1 | C. | 0.05 mol•L-1 | D. | 0.04 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在原电池中,物质在负极发生氧化反应 | |
| B. | 在原电池中,电子由正极流向负极 | |
| C. | 在电解池中,物质在阴极发生氧化反应 | |
| D. | 在电解池中,与电源正极相连的电极是阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;  ;
; 
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:填空题
现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________移动(填“向左”、“向右”或“不”);另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中 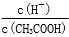 的比值将____________(填“增大”、“减小”或“无法确定”)。
的比值将____________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)___ _______pH(乙)(填“大于”、“小于”或“等于”,下同)。
(3)各取25 mL的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和至pH=7,则消耗的NaOH溶液的体积大小关系为:V(甲)___________V(乙)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
下列能源的大量使用会导致全球进一步变暖、雾霾天气增多的是( )
A.地热能 B.太阳能 C.氢能 D.化石能源
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com