
分析 (1)依据反应2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)可知,每2摩尔乙炔参加反应,转移20mol电子,现有5NA个电子转移时,放出650kJ的热量,则1mol乙炔反应时可放出1300kJ的热量,据此解答;
(2)23g某液态有机物和一定量的氧气混合点燃,恰好完全反应,生成27g液态水和22.4LCO2(标准状况),27g液态水中含有氢元素3g即3mol,22.4LCO2(标准状况)含有碳元素12g即1mol,根据元素守恒可知,23g某液态有机物中含有氧元素8g即0.5mol,所以该有机物中含有CHO的物质的量之比为2:6:1,所以该有机物为C2H6O,23gC2H6O完全燃烧放出683.5KJ的热量,则1molC2H6O完全燃烧会放出1367KJ,据此答题;
解答 解:(1)依据反应2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)可知,每2摩尔乙炔参加反应,转移20mol电子,现有5NA个电子转移时,放出650kJ的热量,则1mol乙炔反应时可放出1300kJ的热量,所以此反应燃烧热的热化学方程式为C2H2(g)+2.5O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol,
故答案为:C2H2(g)+2.5O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol;
(2)23g某液态有机物和一定量的氧气混合点燃,恰好完全反应,生成27g液态水和22.4LCO2(标准状况),27g液态水中含有氢元素3g即3mol,22.4LCO2(标准状况)含有碳元素12g即1mol,根据元素守恒可知,23g某液态有机物中含有氧元素8g即0.5mol,所以该有机物中含有CHO的物质的量之比为2:6:1,所以该有机物为C2H6O,23gC2H6O完全燃烧放出683.5KJ的热量,则1molC2H6O完全燃烧会放出1367KJ,所以此反应的热化学方程式为C2H6O(l)+2O2(g)═3H2O(l)+2CO2(g)△H=-1367KJ/mol,
故答案为:C2H6O(l)+2O2(g)═3H2O(l)+2CO2(g)△H=-1367KJ/mol.
点评 本题考查了热化学方程式的书写,难度不大,注意掌握热化学方程式的书写规则尤其中燃烧热的概念.


科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液 | B. | 较浓稀硫酸 | C. | 碳酸钠溶液 | D. | 硝酸银溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
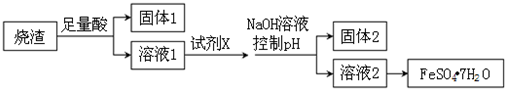
| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O | |
| D. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,如果1mol H原子所具有的能量为E1,1mol H2所具有能量为E2,则2E1=E2 | |
| B. | 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | |
| C. | $\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{2}$BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| D. | 3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+135.9kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 正反应吸热,且B一定为气态 | |
| B. | 混合气体的平均摩尔质量随温度变化如图2所示 | |
| C. | 平衡后保持恒容,充入稀有气体,A的转化率增大 | |
| D. | 平衡后保持恒压,充入稀有气体,C的百分含量减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com