
【题目】氨气是一种重要的化工原料,在工农业中都有广泛的应用。
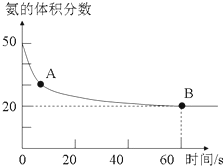
(1)NH3和CO2在120℃和催化剂的作用下可以合成尿素,反应方程式为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)。某实验小组向一个容积不变的真空密闭容器中充入CO2与NH3合成尿素,在恒定温度下,混合气体中NH3的体积分数随时间的变化关系如图所示(该条件下尿素为固体)。A点的正反应速率v正(CO2)___ (填“大于”“小于”或“等于”)B点的逆反应速率v逆(CO2),NH3的平衡转化率为__。
CO(NH2)2(s)+H2O(g)。某实验小组向一个容积不变的真空密闭容器中充入CO2与NH3合成尿素,在恒定温度下,混合气体中NH3的体积分数随时间的变化关系如图所示(该条件下尿素为固体)。A点的正反应速率v正(CO2)___ (填“大于”“小于”或“等于”)B点的逆反应速率v逆(CO2),NH3的平衡转化率为__。
(2)氨基甲酸铵(NH2COONH4)是合成尿素过程的中间产物,现 将体积比为2∶1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生反应并达到平衡:2NH3(g)+CO2(g)![]() NH2COONH4(s)。实验测得在不同温度下的平衡数据如下表:
NH2COONH4(s)。实验测得在不同温度下的平衡数据如下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总浓度 (10-3mol·L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.6 |
①上述反应的焓变:ΔH__0,熵变ΔS__0(填“>”“<”或“=”)。
②下列说法能说明上述反应建立化学平衡状态的是_______。
A.混合气体的平均相对分子质量不再发生变化
B.混合气体中NH3与CO2的浓度之比不再发生变化
C.混合气体的密度不再发生变化 D.v正(NH3)=2v逆(CO2)
③根据表中数据,列出25.0℃时该反应的化学平衡常数的计算式K=_____(不要求计算结果),该反应温度每升高10℃,化学平衡常数就变为原来的______倍。
【答案】大于 75% < < C、D ![]()
![]()
【解析】
(1)图象分析氨气的体积分数从50%变化为20%后体积分数保持不变,说明B点反应达到平衡状态,A点氨气体积百分含量大于B的氨气体积百分含量,说明反应正向进行达到平衡状态,A点的正反应速率大于B点的正反应速率;依据氨气的体积分数结合平衡三段式列式计算平衡转化率;
(2)①根据表中的数据温度越高,则平衡气体的总浓度越大,所以升高温度,平衡逆向移动,正反应反应是放热反应;反应物是气体,产物是固体,该反应是熵减小的过程;
②反应2NH3(g)+CO2(g)![]() NH2COONH4(s)达到平衡状态的判断要紧扣平衡状态的特征,同一反应物或生成物表示的正、逆反应速率相等或反应体系各物质的量不再随时间变化而变化;此反应的特征时生成物为固体,从反应物开始进行时反应物的变化量与起始量的比值相等,始终保持不变,另外混合气体的组分也始终保持不变,即混合气体的平均相对分子质量操持不变,无法确定是否是平衡状态;
NH2COONH4(s)达到平衡状态的判断要紧扣平衡状态的特征,同一反应物或生成物表示的正、逆反应速率相等或反应体系各物质的量不再随时间变化而变化;此反应的特征时生成物为固体,从反应物开始进行时反应物的变化量与起始量的比值相等,始终保持不变,另外混合气体的组分也始终保持不变,即混合气体的平均相对分子质量操持不变,无法确定是否是平衡状态;
③根据平衡三段式计算各物质的平衡浓度,再根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行列式;结合表格判断每升高10℃判断平衡常数的变化规律。
(1)氨气的体积分数从50%变化为20%后体积分数保持不变,说明B点反应达到平衡状态,A点氨气体积百分含量大于B的氨气体积百分含量,说明反应正向进行达到平衡状态,A点的正反应速率大于B点的正反应速率,故v正(CO2)>v逆(CO2);
设氨气消耗物质的量x,开始氨气体积分数为50%,假设氨气为50mol,二氧化碳为50mol,
CO2 + 2NH3![]() (NH2)2CO+H2O
(NH2)2CO+H2O
起始量(mol) 50 50 0 0
变化量(mol) 0.5x x 0.5x 0.5x
平衡量(mol) 50-0.5x 50-x 0.5x 0.5x
氨气的体积分数=![]() =20%;解得x=37.5mol;氨气的平衡转化率=
=20%;解得x=37.5mol;氨气的平衡转化率=![]() ×100%=75%;
×100%=75%;
(2)①根据表中的数据温度越高,则平衡气体的总浓度越大,所以升高温度,平衡逆向移动,正反应反应是放热反应,故△H<0;反应物是气体,产物是固体,该反应是熵减小的过程,即,△S<0;
②反应2NH3(g)+CO2(g)NH2COONH4(s)中,开始加入的NH3与CO2物质的量之比为2:1,而反应消耗的NH3与CO2物质的量之比也是2:1,因此反应的任意时刻二者物质的量之比是2:1,因此浓度之比2:1不能作为平衡的标志.由于NH2COONH4为固体,气体只有NH3和CO2,并且无论是否平衡,二者的物质的量之比不变,则平均相对分子质量不变,所以平均相对分子质量不能作为平衡的标志;随反应的进行,气体质量减小,达到平衡时,质量不再发生变化,反应过程容器体积不变,因此密度可作为平衡的标志,因此C、D符合题意;故答案为:C、D;
③反应NH2COONH4(s)![]() 2NH3(g)+CO2(g),设二氧化碳浓度的变化量x,
2NH3(g)+CO2(g),设二氧化碳浓度的变化量x,
2NH3(g)+CO2(g)![]() NH2COONH4(s)
NH2COONH4(s)
初始浓度 0 0
变化浓度:2x x
平衡浓度:2x x
则3x=4.8×10-3mol/L,即x=1.6×10-3mol/L,2x=3.2×10-3mol/L,K=![]() =
=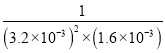 ;
;
根据表中数据分析,反应每升高10℃,平衡时气体的总浓度就变为原来的2倍,化学平衡常数就变为原来的![]() 倍。
倍。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】聚丙烯酸钠(![]() )具有超强吸水性,能吸收空气中的水分,可用于矿 山道路运输抑尘等。下列叙述不正确的是( )
)具有超强吸水性,能吸收空气中的水分,可用于矿 山道路运输抑尘等。下列叙述不正确的是( )
A. 聚丙烯酸钠属于纯净物 B. 聚丙烯酸钠可用于生产尿不湿
C. 聚丙烯酸钠的单体为CH2=CH—COONa D. 路面喷洒聚丙烯酸钠溶液能抑制扬尘,一定程度上能预防雾霾和 PM2.5
查看答案和解析>>
科目:高中化学 来源: 题型:
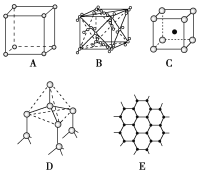
【题目】如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分:
请回答下列问题:
(1)代表金刚石的是________(填编号字母,下同),其中每个碳原子与________个碳原子最接近且距离相等。金刚石属于________晶体。
(2)代表石墨的是________,每个正六边形占有的碳原子数平均为________个。
(3)代表NaCl的是________,每个Na+周围与它最接近且距离相等的Na+有________个。
(4)代表CsCl的是________,它属于________晶体,每个Cs+与________个Cl-紧邻。
(5)代表干冰的是________,它属于________晶体,每个CO2分子与________个CO2分子紧邻。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
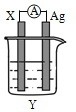
(1)电极X的材料是______;电解质溶液Y是AgNO3,则在银电极上析出______单质;
(2)银电极为电池的______极,发生的电极反应为______;X电极上发生的电极反应为______;
(3)外电路中的电子是从______电极流向______电极(从铜、银中选填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于A2(g)+3B2(g)![]() 2AB3(g)反应来说,以下化学反应速率的表示中,最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,最快的是
A. v(A2)=0.008 mol·L-1·s-1B. v(A2)=0.3 mol·L-1·min-1
C. v(AB3)=0.01 mol·L-1·s-1D. v(B2)=0.012 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。
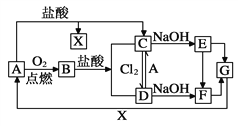
(1)写出A、C、F、G的化学式:A________,C_________,F_________,G_________。
(2)检验D中阳离子的方法_____________________________________________。
(3)保存C溶液时为什么要加固体A_____________________________________。
(4)写出下列转化的离子方程式C→D:____________________________________,由E转化为F的现象是 _________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.010mol/L的这四种溶液pH与该元素原子半径的关系如下图所示。下列说法正确的是

A. 简单离子半径:X>Y>Z>W
B. X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性
C. 气态氢化物的稳定性:Z>W>Y
D. Y元素存在同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0 mol PCl3和1.0 mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)![]() PCl5(g)。达平衡时,PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时,下列说法不正确的是
PCl5(g)。达平衡时,PCl5为0.40 mol,如果此时移走1.0 mol PCl3和0.50 mol Cl2,在相同温度下再达平衡时,下列说法不正确的是
A. PCl5的物质的量大于0.20 molB. PCl5的质量分数减少
C. 平衡常数不变D. 混合气体的黄绿色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种化合物,有的是药物,有的是香料。它们的结构简式如下所示:
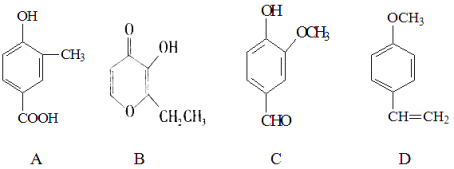
(1)化合物A的分子式是 ;A中含有的官能团的名称是 、
(2)A、B、C、D四种化合物中互为同分异构体的是(填序号) ;
(3)化合物B的核磁共振氢谱中出现 组峰;
(4)1mol D最多能与 mol的氢气发生加成反应;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com