
| A. | 1molCH4 分子中含 10NA个电子 | B. | 22.4LCH4 分子中含 4NA 个共价键 | ||
| C. | 乙烯不能使溴水褪色 | D. | 苯属于烯烃 |
科目:高中化学 来源: 题型:解答题
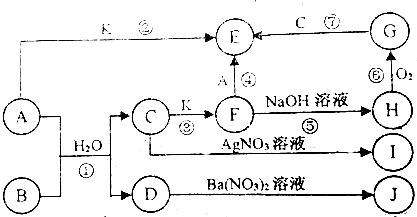
| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 蓝 | Cl2+2I-=I2+2Cl- |
| 继续通入气体 | 溶液逐渐变成无色 | 5Cl2+I2+6H2O=2HIO3+10HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
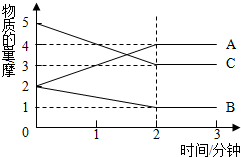 在容积为2升的密闭容器中,进行某可逆反应,反应过程中各物质的量的变化情况如图所示,其中A、B、C都为气体.则该反应的化学方程式为2C+B?2A.
在容积为2升的密闭容器中,进行某可逆反应,反应过程中各物质的量的变化情况如图所示,其中A、B、C都为气体.则该反应的化学方程式为2C+B?2A.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H8O2的酯有4种结构 | |
| B. | 淀粉和纤维素互为同分异构体 | |
| C. | 乙醇和葡萄糖均能发生酯化反应 | |
| D. | 用氢氧化钠溶液可以鉴别地沟油和矿物油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
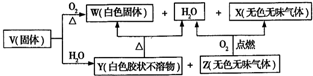
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
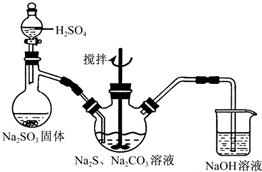 硫代硫酸钠(Na2S2O3)俗称海波,可用于纸浆漂白作脱氯剂等.实验室通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2.
硫代硫酸钠(Na2S2O3)俗称海波,可用于纸浆漂白作脱氯剂等.实验室通过如下反应制取:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做“钠与水的反应”实验时,切取绿豆粒大小的金属钠,用滤纸吸干表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象 | |
| B. | 用蒸馏法提纯物质时,如果把温度计水银球位于蒸馏烧瓶支管口下方,会使收集的产品中混有低沸点的杂质 | |
| C. | 制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸,加热3~5min,将导气管插入饱和Na2CO3溶液中以便于除去乙醇和乙酸 | |
| D. | 为检验皂化反应进行程度,取几滴反应液,滴入装有热水的试管中,振荡,若有油滴浮在液面上,说明油脂已完全反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com