
在一化学反应中,其产物的总能量为60kJ,如果该反应是放热反应,那么反应物的总能量可能是 ( )
A.80kJ B.50kJ C.30kJ D.20kJ
科目:高中化学 来源: 题型:

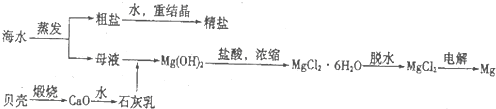
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
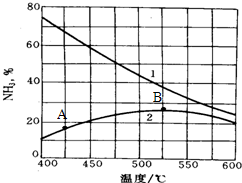
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 反应过程 | 化学方程式 | △H(kJ?mol-1) |
| 甲醇合成反应 | 2H2(g)+CO(g)=CH3OH(g) | -90.8 |
| 水煤气变换反应 | CO(g)+H2O(g)═CO2(g)+H2(g) | -41.3 |
| 甲醇脱水反应 | 2CH3OH(g)=CH3OCH3(g)+H2O(g) | -23.5 |
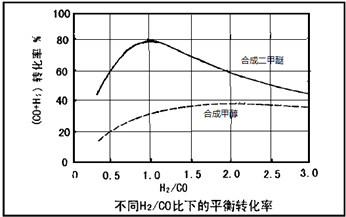
查看答案和解析>>
科目:高中化学 来源:2012-2013学年福建省晋江市养正中学高二下学期第一次月考化学试卷(带解析) 题型:填空题
(16分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2 L的密闭容器中加入0.2 mol的N2和0.6 mol的H2在一定条件下发生反应: N2(g) +3H2(g) 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)= 。平衡时H2的转化率为 。?
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)= 。平衡时H2的转化率为 。?
(2)平衡后,若要提高H2的转化率,可以采取的措施有 。?
A.加了催化剂 B.增大容器体积?C.降低反应体系的温度 D.加入一定量N2?
(3)若在0.5 L的密闭容器中,一定量的氮气和氢气进行如下反应:?
N2(g)+3H2(g) 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:?
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:?
| T/℃ | 200 | 300 | 400 |
| K | K1 | K3 | 0.5 |
 N2(g)+3H2(g)的化学平衡常数为 。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正 v(N2)逆(填“<”“>”或“=”)。?
N2(g)+3H2(g)的化学平衡常数为 。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正 v(N2)逆(填“<”“>”或“=”)。?查看答案和解析>>
科目:高中化学 来源:2014届福建省晋江市高二下学期第一次月考化学试卷(解析版) 题型:填空题
(16分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2 L的密闭容器中加入0.2 mol的N2和0.6 mol的H2在一定条件下发生反应: N2(g)
+3H2(g) 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)= 。平衡时H2的转化率为 。?
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)= 。平衡时H2的转化率为 。?
(2)平衡后,若要提高H2的转化率,可以采取的措施有 。?
A.加了催化剂 B.增大容器体积?C.降低反应体系的温度 D.加入一定量N2?
(3)若在0.5 L的密闭容器中,一定量的氮气和氢气进行如下反应:?
N2(g)+3H2(g) 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:?
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:?
|
T/℃ |
200 |
300 |
400 |
|
K |
K1 |
K3 |
0.5 |
请完成下列问题:?
①试比较K1、K2的大小,K1 K2(填“<”“>”或“=”);?
②下列各项能作为判断该反应达到化学平衡状态的依据是 (填序号字母)
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2? B.v(H2)正=3v(H2)逆?
C.容器内压强保持不变?D.混合气体的密度保持不变?
③400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数为 。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正 v(N2)逆(填“<”“>”或“=”)。?
N2(g)+3H2(g)的化学平衡常数为 。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正 v(N2)逆(填“<”“>”或“=”)。?
(4)根据化学反应速率和化学平衡理论,联系合成氨的生产实际,你认为下列说法不正确的是 。
A.化学反应速率理论可指导怎样在一定时间内快出产品?
B.勒夏特列原理可指导怎样使用有限原料多出产品?
C.催化剂的使用是提高产品产率的有效方法?
D.正确利用化学反应速率和化学反应限度理论都可以提高化工生产的综合经济效益
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com