
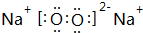
 ,1个H3O+中含有11个质子,1molH3O+的粒子中有11mol质子,
,1个H3O+中含有11个质子,1molH3O+的粒子中有11mol质子, ;11;
;11;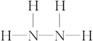 ,
,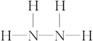 .
.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 7.8 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质结构信息 | 室温下单质呈粉末状固体,加热易熔化;单质在氧气中燃烧,发出明亮的蓝紫色火焰 | 单质常温、常压下是气体,能溶于水;原子的M层上只有1个未成对的p电子 | 单质质软、银白色固体、导电性强;单质在空气中燃烧发出黄色火焰 | 原子最外电子层上s电子数等于p电子数;单质为空间网状晶体,具有很高的熔、沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )| A、铜电极附近观察到黄绿色气体 |
| B、石墨电极附近溶液呈红色 |
| C、溶液中的Na+向石墨电极移动 |
| D、铜电极上发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com